
【题目】请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号)。
a.离子键 b.共价键 c.配位键 d.氢键
(3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)Ti晶体的原子堆积方式为六方堆积(如图所示),则晶体中Ti原子的配位数是___,某Ti配合物的化学式是[Ti (H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是___。
![]()
(5)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。
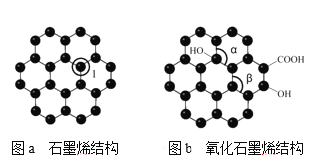
图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );若将图b所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_____(填元素符号)。
【答案】M 9 bcd 大于 Zn核外电子排布为全满稳定结构,较难失电子 12 6NA 3 < H、O
【解析】
(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2;
(2)晶体Q中各种微粒间的作用力为共价键、配位键和氢键;
(3)Zn的价电子排布式为3d104s2, Zn的4s为全满稳定结构,较难失电子;
(4)以轴线原子为研究对象,层内有6个原子相邻,上下两层各有3个原子与之相邻,故配位数为12;配合物[Ti (H2O)5Cl]Cl2·H2O中中心离子Ti3+与5个水分子和1个氯离子形成配位键;
(5)由图可知,a中1号C与相邻C形成3个C-C键,形成σ键的个数为3;b中形成键角α的C原子以sp3杂化,为四面体构型,形成键角β的C原子杂化方式均为sp2,为平面结构;氧化石墨烯中含有羟基、羧基,与水分子间形成氢键。
(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道,故答案为:M;9;
(2)晶体Q中,非金属元素原子之间形成共价键; 中B原子含有空轨道,O原子含有孤电子对,B原子和O原子之间形成配位键;
中B原子含有空轨道,O原子含有孤电子对,B原子和O原子之间形成配位键; 中水分子中的O原子与
中水分子中的O原子与 中H原子形成氢键,则晶体Q中各种微粒间的作用力为共价键、配位键和氢键,故答案为:bcd;
中H原子形成氢键,则晶体Q中各种微粒间的作用力为共价键、配位键和氢键,故答案为:bcd;
(3)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,Zn的4s为全满稳定结构,较难失电子,故第一电离能I1(Zn)大于I1(Cu),故答案为:大于;Zn核外电子排布为全满稳定结构,较难失电子;
(4)由图可知,Ti晶体的原子堆积方式为六方堆积,以轴线原子为研究对象,层内有6个原子相邻,上下两层各有3个原子与之相邻,故配位数为12;配合物[Ti (H2O)5Cl]Cl2·H2O中中心离子Ti3+与5个水分子和1个氯离子形成配位键,则含有配位键的数目为6NA,故答案为:12;6NA;
(5)由图可知,a中1号C与相邻C形成3个C-C键,形成σ键的个数为3;b中形成键角α的C原子形成3个C-C及1个C-O键,C原子以sp3杂化,为四面体构型,而形成键角β的C原子杂化方式均为sp2,为平面结构,则键角α小于键角β;氧化石墨烯中含有羟基、羧基,与水分子间形成氢键,从而促进氧化石墨烯溶解,则氧化石墨烯中可与H2O形成氢键的原子为H和O,故答案为:3;<;H、O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
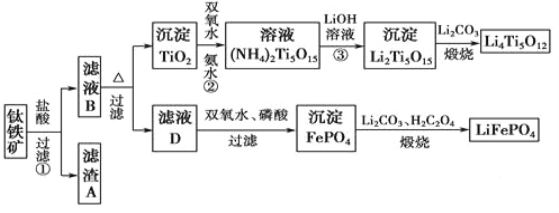
(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
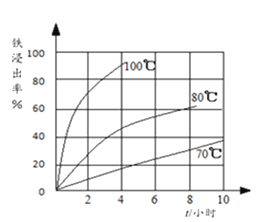
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。

(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
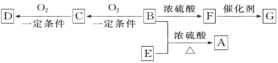
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是
A. [Co(NH3)6]Cl3中Co的化合价是+3B. H2O2 的电子式:![]()
C. NH3和NH4Cl化学键类型相同D. 中子数为32,质子数为27的钴原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图是一套制取并验证氯气部分化学性质的实验装置(装置A制取氯气)。
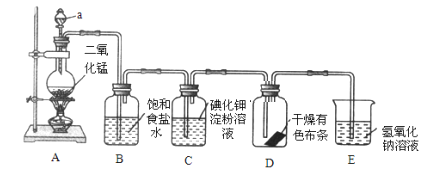
回答下列问题:
(1)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__,__。
(2)若要证明干燥的Cl2无漂白性,可在装置D前添加一个装有__的洗气瓶。
(3)装置E的作用是___,该反应的离子方程式为__。
II.欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500mL。
(4)所需浓硫酸的体积为___mL。
(5)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(6)操作正确的顺序为___(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
(7)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.5mol·L-1(填“大于”“小于”或“等于”)。
(8)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气的主要成分为粉尘、空气、H2O、NOx,其中NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00 L烟道气样经除尘、干燥后缓慢通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3,除去多余的H2O2并加水稀释至100.00 mL。量取20.00 mL该溶液,加入30.00 mL 0.01000 mol·L1FeSO4标准溶液(过量),充分反应后,用0.001000 mol·L1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00 mL。滴定过程中发生如下反应:
Fe2+ + NO3 + H+ — NO↑ + Fe3+ + H2O (未配平)
![]() + Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
(1)NO被H2O2氧化为NO3的离子方程式是_________。
(2)配制100mL 0.001000 mol·L1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有_________、_________。
(3)若FeSO4标准溶液部分变质,会使NOx含量测定结果_________(填“偏高” 、“偏低”或“无影响 ”)。
(4)标准状况下该工厂烟道气中NOx(折合成NO2)的含量为_________mg·m3(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH+NH4++HCO3=BaCO3↓+NH3·H2O+H2O
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.用铁电极电解氯化钠溶液:2Cl+2H2O![]() 2OH+H2↑+Cl2↑
2OH+H2↑+Cl2↑
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。
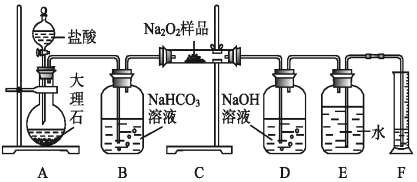
上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是
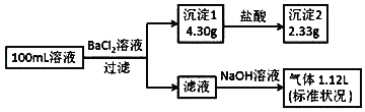
A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com