
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.
(1)冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:I.As2 S3与过量的S2一存在以下反应:As2S3+3S2﹣2AsS ![]()
II.亚砷酸盐的溶解性大于相应砷酸盐
①亚砷酸中砷元素的化合价为 .
②砷酸的电离方程式为 .
③“一级沉砷”中FeSO4的作用是 .
④“二级沉砷”中H2 O2与含砷物质反应的化学方程式为 .
⑤沉淀X为(填化学式).
(2)冶炼废渣中的砷元素主要以As203的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0x 10 ﹣6g).
步骤1:取10g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成AsH3气体.
步骤2:将AsH3气体通人AgNO3溶液中,生成银镜和As2 O3 .
步骤3:取1g废渣样品,重复上述实验,未见银镜生成.
①AsH3的电子式为 .
②步骤2的离子方程式为 .
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5gkg一1 , 请通过计算说明该废渣是否符合排放标准 .
【答案】
(1)+3;H3AsO4?H++H2AsO4﹣;除去过量的硫离子,As2S3+3S2﹣?2AsS32﹣使平衡逆向进行,提高沉砷效果;H2AsO3+H2O2=H3AsO4+H2O;CaSO4
(2)![]() ;12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+;该废渣中砷元素含量超过3.0×10﹣4g/kg,不符合排放标准
;12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+;该废渣中砷元素含量超过3.0×10﹣4g/kg,不符合排放标准
【解析】解:(1)①亚砷酸(H3AsO3)中,氧元素化合价为﹣2价,氢元素化合价为+1价,砷元素化合价设为x,+1×3+x+(﹣2)×3=0,x=+3,
所以答案是:+3;②第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4H++H2AsO4﹣ ,
所以答案是:H3AsO4H++H2AsO4﹣;③“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2﹣2AsS32﹣使平衡逆向进行,提高沉砷效果,
所以答案是:除去过量的硫离子,As2S3+3S2﹣2AsS32﹣使平衡逆向进行,提高沉砷效果;④“二级沉砷”中H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;,反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O,
所以答案是:H2AsO3+H2O2=H3AsO4+H2O;⑤流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀、和铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4 ,
所以答案是:CaSO4;(2)①AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As﹣H键,电子式为: ![]() ,
,
所以答案是: ![]() ;②将AsH3气体通人AgNO3溶液中,生成银镜和As2O3 , 结合电荷守恒、原子守恒配平书写离子方程式为:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+ ,
;②将AsH3气体通人AgNO3溶液中,生成银镜和As2O3 , 结合电荷守恒、原子守恒配平书写离子方程式为:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+ ,
所以答案是:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+;③As的最低检出限为3.0x 10 ﹣6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2 O3 . 则10g废渣含砷量最少为3.0x 10 ﹣6g,含砷量大于3.0×10﹣4g/kg>4.0×10一5gkg﹣1 , 不符合排放标准,
所以答案是:该废渣中砷元素含量超过3.0×10﹣4g/kg,不符合排放标准;


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图.下列说法正确的是( ) 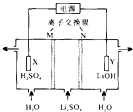
A.N为阳离子交换膜
B.X电极连接电源负极
C.制备2.4 g LiOH产生2.24 L H2(标况)
D.Y电极反应式为O2+2H2O+4e一=40H﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( ) ①AgNO3溶液 ②NaOH溶液 ③水.
A.①②③
B.②①③
C.③②①
D.①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
(1)写出①步反应的化学方程式: .
(2)下列环境问题与NO2的排放有关的是(填字母序号).
A.赤潮
B.光化学烟雾
C.臭氧空洞
D.温室效应
E.酸雨
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3 . 现将一定量的镁粉投入200ml 稀硝酸中,两者恰好完全反应.若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀生成,同时有氨气逸出,且逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g.试回答下列问题:
(1)根据上述信息写出Mg和硝酸反应的化学方程式: .
(2)发生还原反应的硝酸的物质的量为mol.
(3)参加反应的镁的质量为g.
(4)原稀硝酸的物质的量浓度为 molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铵盐的叙述不正确的是( )
A. 所有铵盐中,氮元素化合价都是-3价
B. 所有铵盐都溶于水
C. 铵态氮肥不宜与草木灰混合使用
D. 铵盐都是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下: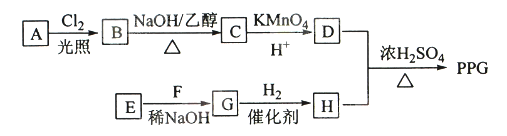
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质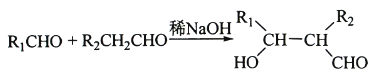
④
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是 (填标号)。
a.质谱仪 b.红外光谱仪c.元素分析仪d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①②
B.②③
C.①④
D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com