
【题目】根据烯烃、炔烃的命名原则,回答下列问题:
(1)有机物![]() 的系统名称为______________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为______________。
的系统名称为______________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为______________。
(2)有机物![]() 的系统名称为_____________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为_____________。
的系统名称为_____________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为_____________。
(3)有机物2-甲基-2-戊烯的结构简式为_________。
(4)某烯烃的错误命名是2-甲基-4-乙基-2-戊烯,则它的正确命名是__________。
【答案】 3-甲基-1-丁烯 2-甲基丁烷 5,6-二甲基-3-乙基-1-庚炔 2,3-二甲基-5-乙基庚烷 ![]() 2,4-二甲基-2-己烯
2,4-二甲基-2-己烯
【解析】(1)由于烯烃是从离碳碳双键较近的一端开始给主链上的碳原子编号,故该有机物的系统名称为3-甲基-1-丁烯,其完全氢化后产物为烷烃,给主链碳原子编号应从离支链最近的一端开始,该烷烃的名称为2-甲基丁烷。(2)依据炔烃的系统命名规则可知,该炔烃的系统名称应为5,6-二甲基-3-乙基-1-庚炔,其完全氢化后得到的烷烃名称为2,3-二甲基-5-乙基庚烷。(3)有机物2-甲基-2-戊烯的结构简式为![]() 。(4)某烯烃的错误命名是2-甲基-4-乙基-2-戊烯,其结构简式为
。(4)某烯烃的错误命名是2-甲基-4-乙基-2-戊烯,其结构简式为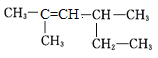 ,则它的正确命名是2,4-二甲基-2-己烯。
,则它的正确命名是2,4-二甲基-2-己烯。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含![]() 、
、![]() 、
、![]() )中各成分的质量分数。取两份质量均为
)中各成分的质量分数。取两份质量均为![]() 的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为
的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为![]() 和
和![]() (已折算到标准状况下)。
(已折算到标准状况下)。
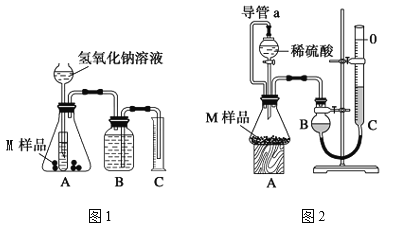
(1)该实验中所用稀硫酸是用98%的浓硫酸![]() 配制的,则该浓硫酸的物质的量浓度是______
配制的,则该浓硫酸的物质的量浓度是______![]() 。
。
(2)写出实验1中可能发生反应的离子方程式:____________________________________。
(3)对于实验2,平视读数前应依次进行的两种操作是:①____________,②____________。
(4)M样品中铜的质量分数的数学表达式为(用![]() 和
和![]() 表示):________________________。
表示):________________________。
(5)该实验需要![]() 的
的![]() 溶液
溶液![]() ,请回答下列问题:
,请回答下列问题:
①配制时应称量______![]() ;
;
②配制![]() 溶液时,
溶液时,![]() 固体中含有
固体中含有![]() 杂质会导致所配溶液浓度______。(填“偏大”、“偏小”或“无影响”,下同)。
杂质会导致所配溶液浓度______。(填“偏大”、“偏小”或“无影响”,下同)。
(6)若拆去实验2中导管a,使测得气体体积______;实验1进行实验前,B瓶中水没有装满,使测得气体体积______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(![]() )的结构与性质的叙述不正确的是( )
)的结构与性质的叙述不正确的是( )
A. 分子中有三种化学环境不同的氢
B. 在光照下与Cl2反应生成的一氯取代产物主要是: ![]()
C. 在一定条件下与HCl反应的加成产物可能有两种
D. 与分子式为C6H12的有机物互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是()。

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,请写出反应的离子方程式____________________________.
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐,是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是______(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为______。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下: FeCl3+ KI= FeCl2+ I2+ KCl,配平上述反应方程式,并在上式上用双线桥法标出该反应电子转移的方向和数目。________
(4)向(3)反应后的溶液中加入CCl4溶液,振荡、静置后会发现_____层(填“上”或“下”)液体的颜色为______色,再将混合液倒入______(填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
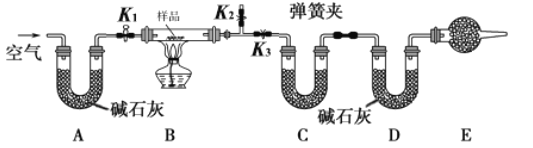
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
(1)请将实验步骤补充完整
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 _____________________。
②称取样品,并将其放入硬质玻璃管中;并称量C、D装置的质量。
③打开活塞K1和K2,关闭K3,缓慢鼓入空气数分钟,其目的是____________________。
④关闭活塞K1和K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后卸下装置,再次称量C、D装置的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对NaCl测定结果的影响是___________(“偏高”、“偏低”或“无影响”)
②E处干燥管中盛放的药品是_______________,其作用是_____________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数______________(“偏高”、“偏低”或“无影响”)
③若样品质量为wg,反应后C、D装置增加的质量分别为m1g和m2g,由此可知混合物中Na2CO3·10H2O的质量分数为______(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )

A. 浓H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 饱和NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com