
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 常温常压下,78g苯中含有碳碳双键的数目为3NA |
分析 A、丙醇中含7个C-H键、2个C-C键、1个C-O键和1个O-H键;
B、H218O与D2O的摩尔质量均为20g/mol;
C、求出二氧化碳的物质的量,然后根据CO2与足量Na2O2的反应为歧化反应来分析;
D、苯分子结构中不含有碳碳双键;
解答 解:A.60g丙醇为1mol,丙醇中含7个C-H键、2个C-C键、1个C-O键和1个O-H键,存在的共价键总数为11NA,故A错误;
B、H218O与D2O的摩尔质量均为20g/mol,故2.0gH218O与D2O混合物的物质的量为0.1mol,而1molH218O与D2O中均含10mol中子,故0.1molH218O与D2O混合物中含1mol中子,即NA个,故B正确;
C、标况下,5.6L二氧化碳的物质的量为0.25mol,而CO2与足量Na2O2的反应为歧化反应,1mol二氧化碳发生反应时反应转移1mol电子,故0.25mol二氧化碳反应时此反应转移0.25mol电子,即0.25NA个,故C错误;
D、苯分子结构中不含有碳碳双键,是完全等同的碳碳键,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜与电源正极相连 | |
| B. | 在海轮外壳上镶入锌块,是牺牲阳极的阴极保护法 | |
| C. | 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
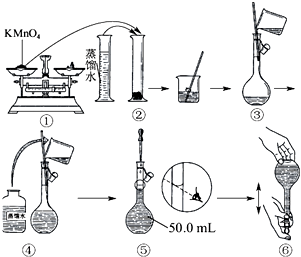 人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.
人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有反应物和产物中都既含极性键又含非极性键 | |
| B. | 消耗22.4L CO2可制得乙酸60g | |
| C. | 该反应不是氧化还原反应 | |
| D. | 该反应过程符合“绿色化学”原理,原子利用率达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH增大和KW不变 | |
| C. | 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| B. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 ,B所含的阳离子是Ba2+.
,B所含的阳离子是Ba2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | T℃时,KW=1.0×10-12.该温度下,PH=3的溶液中,水电离出的c(H+)=1.0×10-11 | |
| B. | 25℃时,PH=a的氨水与PH=b的盐酸等体积混合至溶液呈中性,则a+b=14 | |
| C. | 0.1mol/LNaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,所得溶液中,2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com