
A.1∶10∶100∶1 000 B.14∶13∶12∶1
C.0∶1∶12∶11 D.1∶1∶1∶1
解析:pH=0的HCl溶液,c(H+)=1 mol·L-1,c(OH-)=10-14 mol·L-1,即水电离的c水(H+)=10-14 mol·L-1;0.1 mol·L-1的硝酸,c(H+)=0.1 mol·L-1,同理水电离出的c水(H+)=![]() mol·L-1=10-13 mol·L-1;pH=12的Ba(OH)2溶液,溶液中的H+全部是由H2O电离出,即c水(H+)=10-12 mol·L-1;0.001 mol·L-1的KOH溶液中水电离出的c水(H+)=
mol·L-1=10-13 mol·L-1;pH=12的Ba(OH)2溶液,溶液中的H+全部是由H2O电离出,即c水(H+)=10-12 mol·L-1;0.001 mol·L-1的KOH溶液中水电离出的c水(H+)=![]() mol·L-1=10-11 mol·L-1。所以水电离出的H+的物质的量浓度之比为10-14∶10-13∶10-12∶10-11=1∶10∶100∶1 000。
mol·L-1=10-11 mol·L-1。所以水电离出的H+的物质的量浓度之比为10-14∶10-13∶10-12∶10-11=1∶10∶100∶1 000。
答案:A


科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.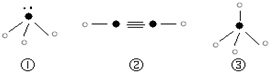
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:全程教与学 题型:013
有M、N、P、E四种元素,有下列实验事实:
①![]()
![]()
![]() ,
,
②P+![]() (冷水)
(冷水)![]()
![]() ,
,
③N和E相连放入E的硫酸盐溶液中,
电极反应式为![]() ,它们的还原性由强到弱顺序是
,它们的还原性由强到弱顺序是
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:013
有M、N、P、E四种元素,有下列实验事实:
①![]()
![]()
![]() ,
,
②P+![]() (冷水)
(冷水)![]()
![]() ,
,
③N和E相连放入E的硫酸盐溶液中,
电极反应式为![]() ,它们的还原性由强到弱顺序是
,它们的还原性由强到弱顺序是
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:
(08宁波市十校联考)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、A13+、Ag+、Ba2+、 OH―、C1―、CO32―、NO3―、SO42―
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
④在E溶液中逐滴加入B溶液,溶液先出现沉 淀,当滴加至过量时,沉淀部分溶解。
试回答下列问题:
(1)A、C的化学式分别为 、 。
(2)A溶液呈碱性的原因 (用离子方程式表示)。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-akJ?mol-1(a>0)。请写出C与B的稀溶液反应的热化学方程式 。
(4)在100mL0.1mol?L-1的E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com