
���� ��Ӧ���е�10sĩ���ﵽƽ�⣬���A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����
3A��g��+B��g��?2C��g��+2D��g��
ƽ�� 1.8 0.6 0.8 0.8
ת�� 1.2 0.4 0.8 0.8
��ʼ 3 1 0 0
���v=$\frac{��c}{��t}$��c=$\frac{n}{V}$��ת����=$\frac{ת������}{��ʼ����}$��100%������Ũ�Ȼ������¶Ȼ�Ӵ����ɼӿ췴Ӧ���������
��� �⣺��Ӧ���е�10sĩ���ﵽƽ�⣬���A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����
3A��g��+B��g��?2C��g��+2D��g��
ƽ�� 1.8 0.6 0.8 0.8
ת�� 1.2 0.4 0.8 0.8
��ʼ 3 1 0 0
��1����A��ʾ10s ������Ӧ�Ļ�ѧ��Ӧ����Ϊ$\frac{\frac{1.2mol}{2L}}{10s}$=0.06mol/��L��s�����ʴ�Ϊ��0.06mol/��L��s����
��2����ӦǰB�����ʵ���Ũ����$\frac{1mol}{2L}$=0.5mol/L���ʴ�Ϊ��0.5mol/L��
��3��ƽ���������D��Ũ��Ϊ$\frac{0.8mol}{2L}$=0.4mol/L���ʴ�Ϊ��0.4mol/L��
��4����ƽ���A��ת����Ϊ$\frac{1.2}{3}$��100%=40%���ʴ�Ϊ��40%��
��5��a����������������Ũ�ȼ�С����Ӧ���ʼ�С���ʲ�ѡ��
b���ʵ������¶ȣ���Ӧ��������ѡ��
c������C��Ũ�ȣ�������Ũ������Ӧ��������ѡ��
d��ѡ���ʵ��Ĵ�������Ӧ���ʼӿ죬��ѡ��
�ʴ�Ϊ��bcd��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η������ʼ�ת���ʼ����Ϊ���Ĺؼ������ط�������������Ŀ��飬ע�����ʵ�����ת����ϵ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
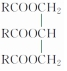 ������ʾ������RΪ̼ԭ����Ŀ����10����������������ͬҲ���Բ�ͬ������ʽΪC51H92O6��ij��֬��ϡ�����м���ˮ���õ�A��B�������ʣ���A����Է�������Ϊ92����֪��R1-CH�TCH-R2$��_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH������
������ʾ������RΪ̼ԭ����Ŀ����10����������������ͬҲ���Բ�ͬ������ʽΪC51H92O6��ij��֬��ϡ�����м���ˮ���õ�A��B�������ʣ���A����Է�������Ϊ92����֪��R1-CH�TCH-R2$��_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH������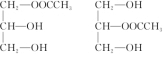 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
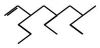 ������ȷ���ǣ�������
������ȷ���ǣ�������| A�� | 5��7-����-3-�һ�-1-��ϩ | B�� | 3-�һ�-5��7-����-1-��ϩ | ||
| C�� | 3-��-5-�һ�-7-����-8-��ϩ | D�� | 7-��-5-�һ�-3-����-1-��ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��CH3��3CCH2OH | B�� | ��CH3CH2��2CHOH | C�� | CH3��CH2��2CH��CH3��OH | D�� | CH3CH2C��CH3��2OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O | B�� | HCl | C�� | NaCl | D�� | CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����û���Ӧ | B�� | A1����ԭ�� | ||
| C�� | Fe2O3����ԭ | D�� | �÷�Ӧ�����ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com