
| A. | SiCl4是氧化剂 | B. | Si3N4是氧化产物 | C. | H2被还原 | D. | N2发生还原反应 |
分析 由3SiCl4+2N2+6H2≡Si3N4+12HCl可知,其中N2中N元素的化合价降低,为氧化剂,N被还原;H2中H元素化合价升高,为还原剂,H被氧化,以此来解答.
解答 解:A.SiCl4在反应中Si、Cl化合价并不发生变化,既不是氧化剂也不是还原剂,故A错误;
B.N元素化合价降低,为氧化剂被还原,则Si3N4是还原产物,故B错误;
C.H元素化合价升高,氢气是还原剂被氧化,故C错误;
D.N元素化合价降低,N2为氧化剂被还原,发生还原反应,故D正确.
故选D.
点评 本题考查氧化还原反应中氧化剂与还原剂的判断,化合价升高的做还原剂,化合价降低的做氧化剂.题目难度不大,是基础题.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl H2S NH4Cl | B. | H2O Na2O2 CO2 | ||
| C. | CaCl2 NaOH MgCl2 | D. | C2H6 H2O2 C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁 | B. | 乙、丙、甲、丁 | C. | 乙、丁、丙、甲 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 除去丁醇中的乙醇 | 蒸馏 | 丁醇与乙醇的沸点相差较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 用热的白碱溶液易洗去油污 | 加热促进Na2CO3水解,提高溶液碱浓度,有利油污反应 |
| B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl发生双水解,反应生成氨气会降低肥效 |
| C | 在钢质船身上装锌块来避免船体受腐蚀 | 锌比铁活泼,构成原电池负极,锌块腐蚀,而保护钢铁 |
| D | 消化系统X射线透视,常用BaSO4做造影剂,但不可用BaCO3 | 硫酸钡Ksp=1.1×10-10小于碳酸钡Ksp=5.1×10-9 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
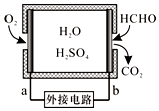 通过传感器可以监测空气中甲醛的含量.一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )
通过传感器可以监测空气中甲醛的含量.一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )| A. | a为电池的正极,发生还原反应 | |
| B. | b极的电极反应为HCHO+H2O-4e-═CO2+4H+ | |
| C. | 传感器工作过程中,电解质溶液中硫酸的浓度减小 | |
| D. | 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com