
钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是

A.乙装置阴极的电极反应式为
TiO2+4e-=Ti+2O2-
B.若不考虑能量的损失,制备24.0g
金属钛,需要消耗金属铝36.0g
C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动
D.乙装置中的石墨电极需要定期更换
D
【解析】
试题分析:根据题给装置知,甲池为原电池,Al电极为负极,被氧化,AgO/Ag电极为正极,发生还原反应,乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙与二氧化钛发生反应:2Ca+TiO2=Ti+2CaO。A、乙装置阴极的电极反应式为2Ca2++4e-═2Ca、2Ca+TiO2=Ti+2CaO,错误;B、n(Ti)=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式Al+4OH---3e-═AlO2-+2H2O可知,需要2/3molAl,质量为18g,错误;C、甲装置工作过程中OH-向负极移动,即向Al极移动,错误;D、因乙装置中的石墨电极不断被消耗,则乙装置中的石墨电极需要定期更换,正确。
考点:考查原电池原理和电解原理的应用。


科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

下列说法正确的是( )
A.固体混合物中一定含有Al,但质量不可确定 B.固体混合物中可能含有MgCl2和AlCl3
C.固体混合物中一定含有MgCl2和FeCl2 D.固体混合物中一定含有 (NH4)2SO4、MgCl2
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:选择题
已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一个平面上是( )
A.苯乙烯 B.苯甲醛
B.苯甲醛
C.苯乙酮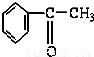 D.苯酚
D.苯酚
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省绍兴市柯桥区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
如图是甲醇/过氧化氢燃料电池内部结构示意图。 工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能。下列说法不正确的是
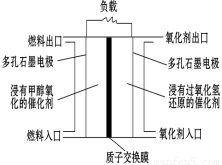
A.该电池的正极反应式:H2O2+2H++2e—=2H2O
B.燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+ 通过质子交换膜流向正极
C.电池工作时,1 mol甲醇被氧化有6 mol电子转移
D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:填空题
(15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
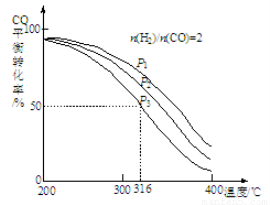
①该反应的平衡常数表达式为 ;P1、P2、P3由大到小的顺序为 。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率 50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,

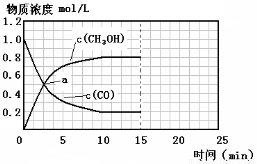
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为 (从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:实验题
(15分)乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 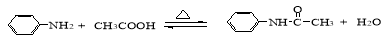
实验参数:
名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
实验装置:(见右图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,
调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是
(2)为何要控制分馏柱上端的温度在105?C左右
(3)通过什么现象可判断反应基本完成
(4)步聚1加热可用 (填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。
(5)洗涤乙酰苯胺粗品最合适的试剂是 。
A. 用少量冷水洗 B. 用少量热水洗
C. 先用冷水洗,再用热水洗 D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:选择题
元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。下列说法正确的是
A.X、Y、Z、W的原子半径的大小关系为:W> Y >Z> X
B.在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等
C.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
D.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
能源与人类的生活和社会发展密切相关。下列关于能源开发和利用的说法不正确的是
A.人类利用的能源都是通过化学反应获得的
B.煤、石油、天然气是不可再生能源
C.在农村提倡利用沼气作生活燃料
D.未来可用乙醇代替汽油作汽车燃料
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.按系统命名法,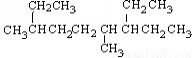 名称:4,7-二甲基-3-乙基壬烷
名称:4,7-二甲基-3-乙基壬烷
B.元素分析仪可以同时对碳、氢、氧、硫等多种元素进行分析
C.用相同浓度的乙醇和苯酚水溶液,分别与相同质量的金属钠反应,来比较两者羟基上氢的活性
D.有机高分子化合物糖类、油脂和蛋白质都是人体必需的营养物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com