
| A、氢氧化钠溶液中滴入紫色石蕊试液,再通入CO2,溶液有蓝变红:CO2+2OH-=CO32-+H2O |
| B、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| C、Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4:5,10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- |
| D、碳酸氢铵溶液中加足量澄清石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3?H2O+H2O |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、SO42-、NH3?H2O |
| B、K+、Al3+、MnO4-、C2H5OH |
| C、K+、Cl-、NO3-、Fe2+ |
| D、Na+、NH4+、NO3-、CH3OOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| C | 确定磷、砷两元素非金属性的强弱 | 测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
实验目的 | 温度/℃ | 催化剂 质量/g |
反应物初始浓度 /10-3mol?L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下两个实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 0 | 7 | 9 | |
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
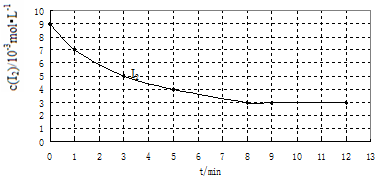
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、NO3-、CO32- |
| B、Mg2+、C1-、OH-、SO42- |
| C、Ca2+、Na+、Fe3+、NO3- |
| D、K+、Cl-、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C三种强电解质,它们在水中电离出的离子如表所示:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com