
【题目】对甲基苯乙酮是重要的化工原料,某实验小组利用如图装置制备对甲基苯乙酮。

制备原理: (放热反应)。 反应物和产物的相关数据列表:
(放热反应)。 反应物和产物的相关数据列表:
试剂名称 | 分子式 | 分子量 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 |
甲苯 | C7H8 | 92 | -93 | 110.6 | 0.8669 |
乙酸酐 | (CH3CO)2 | 102 | -73.1 | 138.6 | 1.08 |
对甲基苯乙酮 | C9H10O | 134 | 28 | 94(0.93kPa) | 1.0051 |
实验步骤:
步骤 1:如图所示,在 100mL 三颈烧瓶上安装搅拌器、仪器 x 和上口装有无水氯化钙的冷凝管,干燥管与一气体 吸收装置相连。
步骤 2:三颈烧瓶中快速加入研碎的催化剂和 20mL 无水甲苯,在搅拌的条件下通过仪器 x 缓慢地滴加 3.4mL 醋酸酐与 5mL 甲苯的混合液,约需 15min 滴完。
步骤 3:反应结束后,将三颈烧瓶在 95℃时加热 25~30min。
步骤 4:反应混合液冷却后转移到盛有 30mL 浓盐酸与 30mL 冰水的烧杯中(目的是将对甲基苯乙酮从其与铝的化 合物中分离出来),用分液漏斗分出有机层、水层。每次用 5mL 甲苯萃取两次,并将所有甲苯层合并,然后依次 用水、10%氢氧化钠溶液、水各 10mL 洗涤有机层,最后用无水硫酸镁处理。
步骤 5:将干燥后的溶液滤入蒸馏瓶,减压蒸馏(整套装置必须是干燥的),收集 94℃(0.93kPa)馏分,得到对甲 基苯乙酮 4.1g。
请回答下列问题:
(1)仪器 x 的名称为________。与普通的分液漏斗相比,本实验采用仪器 x 的优点为_______。
(2)本实验中的氯化铝若水解则会影响催化效率,除了使用干燥管的措施外,还应该采取哪些措施防止水解_____(答两点)。
(3)步骤③中最适宜的加热方式为 _____。
(4)步骤④中加入 10%的氢氧化钠溶液的目的为 _____,加入无水硫酸镁的目的为_________。
(5)步骤④中水层每次用 5mL 甲苯萃取两次并将所有甲苯层合并的目的为________。
(6)步骤⑤中减压蒸馏时所需的冷凝装置能否选用题给装置图中的球形冷能管_____(答“能”或“不能”)。 本实验中,对甲基苯乙酮的产率为_____(结果保留 2 位有效数字)。
【答案】恒压滴液漏斗 平衡压强,保证反应混合液能够顺利滴下 药品、仪器均需干燥;整个装置不漏气;取用氯化铝要快等(三个写两个或其他合理答案即可) 水浴加热 除去有机层中的酸性杂质 除去有机层中的水 将水层中的对甲基苯乙酮更多的萃取出来,提高产率 不能 85%
【解析】
⑴根据实验得知仪器x的名称,恒压滴液漏斗可以平衡压强,保证反应混合液能够顺利滴下。
⑵要防止水解,就需要在无水的环境中,因此本实验需要干燥环境。
⑶步骤③温度要控制在95℃,最好采用水浴加热。
⑷有机层中含有盐酸,除掉酸的过程中含有水份。
⑸主要利用多次萃取提高萃取率。
⑹步骤⑤中减压蒸馏时应选用直形冷凝管;先计算甲苯的物质的量和乙酸酐的物质的量,得到理论上生成产品物质的量,再计算产品的产率。
⑴根据实验得知仪器x的名称为恒压滴液漏斗,与普通的分液漏斗相比,本实验采用恒压滴液漏斗的优点为保证反应混合液能够顺利流下;故答案为:恒压滴液漏斗;平衡压强,保证反应混合液能够顺利滴下。
⑵要防止水解,就需要在无水的环境中,因此本实验中的氯化铝若水解则会影响催化效率,除了使用干燥管的措施外,还应该采取药品、仪器均需干燥;整个装置不漏气;取用氯化铝要快等措施防止水解;故答案为:药品、仪器均需干燥;整个装置不漏气;取用氯化铝要快等(三个写两个或其他合理答案即可)。
⑶步骤③温度要控制在95℃,因此最适宜的加热方式为水浴加热;故答案为:水浴加热。
⑷有机层中含有盐酸,因此步骤④中加入10%的氢氧化钠溶液的目的为除去有机层中的酸性杂质,除掉盐酸后,则物质中含有水份,因此加入无水硫酸镁的目的为除去有机层中的水;故答案为:除去有机层中的酸性杂质;除去有机层中的水。
⑸步骤④中水层每次用5mL甲苯萃取两次并将所有甲苯层合并,主要利用多次萃取提高萃取率,因此其目的为将水层中的对甲基苯乙酮更多的萃取出来,提高产率;故答案为:将水层中的对甲基苯乙酮更多的萃取出来,提高产率。
⑹步骤⑤中减压蒸馏时所需的冷凝装置不能用球形冷能管,应选用直形冷凝管;甲苯的物质的量为25mL×0.8669gmL1÷92 gmol1=0.2356mol,乙酸酐的物质的量为3.4mL×1.08gmL1÷102 gmol1=0.036mol,显然甲苯过量,理论上生成产品0.036mol,故产品的产率为![]() ;故答案为:不能;85%。
;故答案为:不能;85%。


科目:高中化学 来源: 题型:
【题目】5.6g铁粉投入到盛有100mL2molL-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
A. v(H2SO4)=0.5mol (Lmin)-1B. v(H2SO4)=1 mol (Lmin)-1
C. v(Fe)=0.5mol (Lmin)-1D. v(FeSO4)=1mol (Lmin)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有 20 mL0.1mol·L-1 的 NaOH 溶液的绝热容器中加入 pH=2 的 HA 溶液,加入 HA 溶液的体积 V与所得混合溶液温度 T的关系如图所示。 下列说法错误的是

A.25℃时 pH=2 的 HA 溶液中 HA 的电离度约为 10%
B.M 点溶液中存在:c(Na+ ) > c(A-)> c(OH-)> c(H+)
C.P 点溶液中存在:3 c(Na+ )=2 c(HA)+ 2c(A-)
D.M→N→P 的过程中水的电离程度先增大后减小,M 点水电离程度小于 P 点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是
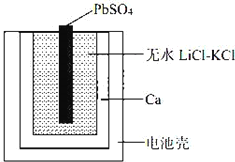
A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1的NaOH溶液滴加到10.00mL0.10mol·L-1HX溶液中,所得滴定曲线如图,已知HX的电离平衡常数为1.0×10-9,下列说法错误的是( )

A.①处pH约为5
B.②处pH一定大于7
C.水的电离程度:③>纯水>②
D.②中离子浓度大小关系:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B、C为原料制取药物AspirinSustained-ReleaseTablets(缓释阿司匹林)的合成路线如图:

已知:ⅰ.A、B为烃,其中A的产量可作为石油化工水平的标志;
ⅱ. 。
。
回答下列问题:
(1)Z所含官能团名称为___。
(2)B和Y的结构简式为__、__。
(3)完成方程式:
①X→CH2OHCH2OH__。
②C→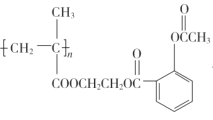 __。
__。
(4)满足以下条件的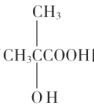 的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
a.能发生水解反应 b.能与钠反应放出氢气 c.能发生银镜反应
(5)以乳酸(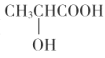 )和甲醇为原料,其他无机试剂任选,设计合成
)和甲醇为原料,其他无机试剂任选,设计合成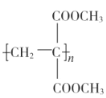 的路线:__。
的路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
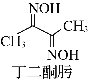
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
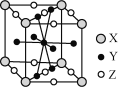
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(![]() )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某![]() 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为_____。
(4)乙醇的沸点高于丙酮,这是因为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com