
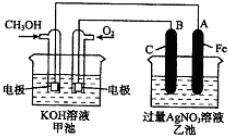
分析 (1)根据方程式及燃料电池的特点判断甲装置;
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极;
(3)O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极B是阳极;
(4)乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3-,依据氧化还原反应的电子守恒,结合反应的物质书写化学方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+O2↑+4HNO3;
(5)先根据得失电子数相等找出银与氧气的关系式,然后计算.
解答 解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,
故答案为:原电池;电解池;
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:负极;CH3OH-6e-+8OH-=CO32-+6H2O;
(3)O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极B是阳极,电极反应是溶液中的氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O;故答案为:阳极;4OH--4e-=O2↑+2H2O;
(4)乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3-,依据氧化还原反应的电子守恒,结合反应的物质书写化学方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+O2↑+4HNO3,故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+O2↑+4HNO3;
(5)根据得失电子数相等,氧气与银的关系式为:
O2~~~~4Ag
22.4L ( 4×108 )g
0.28L 5.4g,
即$\frac{22.4L}{V}=\frac{4×108g}{5.4g}$
故答案为:280.
点评 原电池、电解池的判断方法:
1、若无外加电源,可能是原电池,然后再根据原电池的形成条件判定.
2、若有外接电源,两电极插入电解质溶液中,可能是电解池或电镀池,当阳极金属与电解质溶液中的金属阳离子相同时,则为电镀池.
3、若无明显外接电源的串联电路,则利用题中信息找出能自发进行氧化还原反应的装置为原电池.


科目:高中化学 来源: 题型:选择题
| A. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 常温下,pH=2的CH3COOH溶液和H2SO4溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离出的c(H+)不相等 | |
| C. | 常温下将浓度为0.1 mol•L-1的HF溶液加水不断稀释,溶液中$\frac{c({H}^{+})}{c(HF)}$的值始终保持增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Fe(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
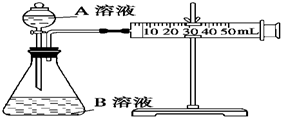 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,“氢化油”呈液态 | |
| B. | 纤维素和淀粉均属于“糖类,它们在人体内水解的最终产物均为葡萄糖 | |
| C. | 要鉴别石蜡油中是否混有少量苯,可加入四氯化碳,萃取,观察是否分层 | |
| D. | 用灼烧闻气味的方法来区别棉织物和毛织物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com