
①用坩埚准确称取2.0 g硫酸铜晶体,记下坩埚和硫酸铜晶体的总质馈m1;
②将盛有硫酸铜品体的坩埚放在三角架上而的泥三角上,缓慢加热,直到蓝色的硫酸铜品体完全变成白色,且不再有水蒸气逸出,然后将坩埚冷却;
③待坩埚冷却后,将坩埚放在天平上称量,记下坩埚和无水硫酸铜的总质量m2。
(1)②中加热硫酸铜晶体时所用的仪器有____________________________________________。
(2)上述每一步实验中,都有一个很关键的步骤没有给出,它们是①______________________;②_________________________;③____________________________。
(3)写出硫酸铜晶体(CuSO4·xH2O)中结晶水的表达式x=_______________________。
(4)该小组最终测定的结果偏高,其原因可能是(选填字母序号)________________________。
A.取出的硫酸铜晶体未研成粉末,就开始加热
B.在①中称量坩埚和硫酸铜晶体时,天平指针偏右
C.加热时,硫酸铜晶体刚变为白色,就停止加热
D.将加热后的白色粉末放在空气中冷却
科目:高中化学 来源: 题型:
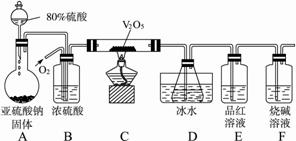
请填空:
(1)装置B的三个作用是① ;② ;③ 。
(2)实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是 。
(3)D中锥形瓶中盛放的溶液可以是(选填序号) 。
①足量澄清石灰水 ②足量小苏打溶液
③足量氯化钡溶液 ④足量硝酸钡溶液
反应停止后,根据装置D锥形瓶中产生的白色沉淀的量,测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步实验操作是(简述过程) 。
(4)若从锥形瓶溶液中得到的沉淀质量为m g。要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是(选填序号) ,二氧化硫的转化率是 (用含有m、a、b、c、d中的一种或几种字母的代数式表示)。
①装置F增加的质量a g
②装置A中亚硫酸钠减少的质量b g
③装置B增加的质量c g
④装置E增加的质量d g
查看答案和解析>>
科目:高中化学 来源: 题型:

试填空:(1)装置B的三个作用是①__________;②__________;③__________。
(2)实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是__________。
(3)D中锥形瓶中盛放的溶液可以是(选填序号)__________。
①足量澄清石灰水 ②足量小苏打溶液 ③足量氯化钡溶液 ④足量硝酸钡溶液
反应停止后,再根据装置D锥形瓶中产生的白色沉淀的量,测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步实验操作是(简述过程) ______________________________。
(4)若从锥形瓶溶液中得到的沉淀质量为m g,要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是__________ (选填序号),二氧化硫的转化率是__________ (用含有m、a、b、c、d中的一种或几种字母的代数式表示)。
①装置F增加的质量a g ②装置A中亚硫酸钠减少的质量b g ③装置B增加的质量c g ④装置E增加的质量为d g
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)装置C中盛放NaOH溶液的作用是__________________________________。
(2)①证明分解产物中有CO2的现象是__________________________________。
②证明分解产物中有CO的现象是_____________________________________。
(3)实验结束后,装置F中黑色氧化铜变为红色固体。简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):_____________________________________________________________________。
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化。KMnO4和草酸钠在稀硫酸中反应的离子方程式是______________________________________________。
②实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取0.200 0 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,用配置好的KMnO4溶液滴定。当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30 s内不褪色,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 |
滴定管液面刻度 | 0.00 mL | 16.02 mL | 16.00 mL | 16.01 mL |
KMnO4溶液的物质的量浓度的计算式是:?
c(KMnO4)=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)使用铜和稀硫酸制备硫酸铜晶体?
步骤如下:?
![]()
步骤①观察到的现象是 。?
步骤③的主要操作包括: 。
(2)某硫酸铜晶体(CuSO4·nH2O)中含有少量的氯化钠,实验室里测定结晶水n的数值?
A.在实验过程中要用到下列仪器中的 (填序号,下同)。?
①容量瓶 ②托盘天平 ③烧杯 ④锥形瓶 ?⑤漏斗? ⑥干燥器 ⑦长颈漏斗 ⑧试管 ⑨试管夹 ?⑩坩埚?
B.在下列操作中,选用必要的步骤,按操作先后顺序排列 。?
①称量硫酸铜晶体 ②加水溶解 ③过滤 ④加过量AgNO3溶液 ⑤称出加热后固体质量 ⑥加热⑦加过量BaCl2溶液 ⑧称量沉淀?
C.在以上操作中,若硫酸铜晶体质量为a g,沉淀质量为b g,加热后固体质量为c g,则a g硫酸铜晶体中结晶水n为 。?
(3)硫酸铜溶解度的测定?
用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是 。
已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是 。?
(4)已知铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。请写出该反应的化学方程式: 。?
查看答案和解析>>
科目:高中化学 来源: 题型:
某校学生课外活动小组现欲用下图的仪器和药品制取纯净的一氧化碳(用浓硫酸干燥)并进行还原氧化铜实验(要求实验中不排放有害气体)。图中A---I表示玻璃管接口。
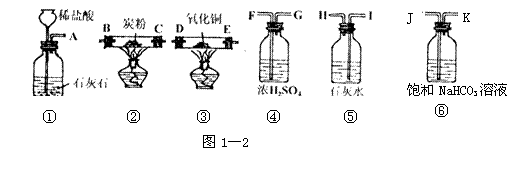
请从实验的科学性和安全性方面考虑,回答下列问题:
(1)装置①中所发生反应的化学方程式是 。
(2)实验装置的连接顺序是(填字母符号) 。
(3)装置④中浓硫酸的作用是 。
(4)实验中证明氢气有还原性的现象是 。
(5)在实验中不排放有害气体应该怎样操作?
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com