
【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
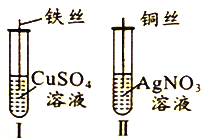
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。
【答案】AgNO3=Ag++NO3- 铁丝上有红色固体析出 氧化性Ag+>Cu2+ Cu+2Ag+=Cu2++2Ag 2 CuSO4、AgNO3在水溶液中电离出自由离子
【解析】
(1)AgNO3是强电解质,在水溶液中完全电离。
(2)①实验Ⅰ,Fe与CuSO4发生置换反应,在铁表面生成紫红色的铜。
②实验Ⅱ,Cu与AgNO3发生置换反应,氧化剂的氧化性大于氧化产物的氧化性。
③实验Ⅱ中,Cu与Ag+发生置换反应。
(3)金属单质属于纯净物,CuSO4溶液、AgNO3溶液中含有自由离子,所以能导电。
(1)AgNO3是强电解质,电离方程式为AgNO3=Ag++NO3-。答案为:AgNO3=Ag++NO3-;
(2)①实验Ⅰ,Fe与CuSO4发生置换反应,在铁表面生成紫红色的铜。答案为:铁丝上有红色固体析出;
②实验Ⅱ,Cu与AgNO3发生置换反应,结论是:氧化性Ag+>Cu2+。答案为:氧化性Ag+>Cu2+;
③实验Ⅱ中,Cu与Ag+发生置换反应,离子方程式为Cu+2Ag+=Cu2++2Ag。答案为:Cu+2Ag+=Cu2++2Ag;
(3)金属单质属于纯净物,其中属于纯净物有Cu、Fe共2种,CuSO4溶液、AgNO3溶液中含有自由离子,所以能导电。答案为:2;CuSO4、AgNO3在水溶液中电离出自由离子。


科目:高中化学 来源: 题型:
【题目】取某固体样品,进行如下实验:
①取a g样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊;
②取20mL溶液,加入足量氯水,无气体产生,再加入CCl4后分层,下层为橙红色;
③将②中溶液分液后,在上层溶液加入足量![]() 和盐酸,产生白色沉淀4.66g;
和盐酸,产生白色沉淀4.66g;
④另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体;
该固体样品可能是( )
A. NH4Cl NaBr (NH4)2SO4
B. CuBr2 NaCl (NH4)2SO3
C. NaBr Na2CO3 (NH4)2SO4
D. NaCl NaBr (NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成 NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质
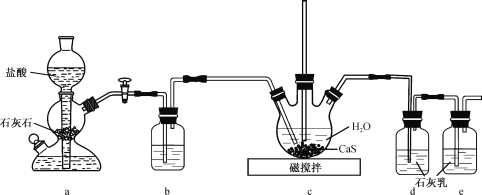
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ______________________________________;装置b中盛放的试剂是__________________ 。
②装置c中的长直导管的作用是____________________________________,三颈烧瓶中通入CO2 不能过量,原因是 ______________________________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________________________;该反应的化学方程式为___________________________________________________________________。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____________(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 __________________________________________________。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42— ,该反应中氧化剂与还原剂的物质的量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.48g 正丁烷和 10g 异丁烷的混合物中共价键数目为 13NA
B.标准状况下,22.4LCl2 与水充分反应,转移电子数为 NA
C.标准状况下,1L 液态水中含有的H+数为 10ˉ7NA
D.2.0g D2O 和 H218O 的混合物中含有的质子数和中子数之和为 1.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
A.1mol<n<2molB.1mol<n<4mol
C.2mol<n≤4molD.1mol<n≤4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用白云石(主要含CaCO3 和MgCO3)和废铝屑制备一种化合物12CaO·7Al2O3。
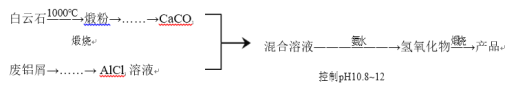
相关信息如下:
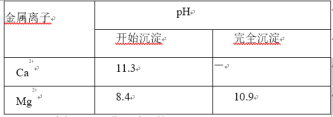
①MgCO3 分解温度低于 CaCO3;
②金属离子形成氢氧化物沉淀的 pH 范围:
③AlCl3 易水解,易升华。请回答:
(1)从煅粉经一系列操作可制备纯净的CaCO3。请给出合理的操作排序(从下列操作中选取,按先后次序列出字母) :________
煅粉→加入适量 NH4NO3 溶液→( )→( )→( )→通入 NH3 和 CO2,控制pH<11.0→过滤→洗涤→CaCO3
a.过滤 b.控制 pH=11.0 c.控制 pH=8.0 d.取滤渣加水形成悬浊液 e.取滤液
(2)煅粉加入 NH4NO3 溶液发生反应的离子方程式是_________。
(3)通入 NH3 和 CO2 时,需控制 pH<11.0 的原因是_________。
(4)下列说法正确的是_________。
A.煅烧时,需用玻璃棒不断搅拌坩埚中固体,使其受热均匀
B.煅烧时产生 CO2 的体积恰好等于制备 CaCO3 时需要通入 CO2 的体积(已换算为相同状况)
C.NH4NO3 溶液还可用(NH4)2SO4、NH4HCO3 等溶液代替
D.过滤时,应选用玻璃砂漏斗,以免滤纸被溶液腐蚀
(5)废铝屑需要先放在乙醇和丙酮混合溶液中,放入超声波清洗器中清洗 30 分钟,目的是 __。取出晾干,用以下装置制备 AlCl3 溶液。请为虚线框中补充必须的装置,并按连接顺序排列 ___(填写代表装置的字母,不考虑橡皮管连接)。
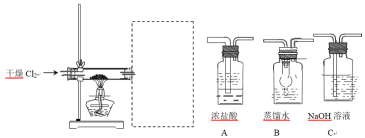
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼矿主要含MoS2,还含有Ca、Si、Cu、Zn、Fe等元素。利用辉钼矿制备仲钼酸铵的新一代清洁生产工艺如下图所示:
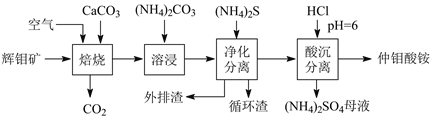
回答下列问题:
(1)焙烧温度为400℃,MoS2转化为CaMoO4和CaSO4,则反应中每摩MoS2转移的电子数为_________。仲钼酸铵(七钼酸铵)中的阴离子是Mo7O24n-,则n=_______。
(2)传统焙烧是在650℃下,使MoS2直接与空气中的O2反应生成MoO3和SO2。图示清洁生产工艺加入CaCO3的优点是______________。
(3)溶浸时,CaMoO4发生复分解反应的化学方程式是___________。循环渣的主要成分是CaCO3,则外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常温下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵(返回溶浸循环使用),原因是_______。
(5)电氧化分解钼精矿时,用惰性电极电解钼精矿和NaCl的混合浆液,电解槽无隔膜,控制溶液pH=9。阴极生成物为________,混合浆液中,阳极产物转化生成的NaClO氧化MoS2生成MoO42-和SO42-的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol NH4+中含有的电子数为11 NA
B.0.1mol·L-1的Ba(OH)2溶液中含有的OH- 数目为0.2NA
C.0.1NA个氯分子溶于1L水中,所得溶液中c(C1-)=0.1mol·L-1
D.1mol NH3溶于水中配成1L溶液,所得氨水的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
I.可利用CH4与CO2制备合成气(CO、H2),在某一钢性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-A12O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)
(1)研究表明CO的生成速率![]() ,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=_________。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
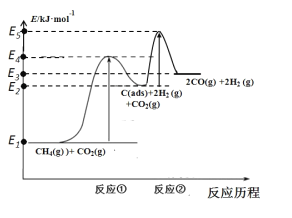
CH4与CO2制备合成气的热化学方程式为__________________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.CO2催化加氢制甲醇5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
i. ![]() ,
,![]()
ii.. ![]()
iii. ![]()
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如右图所示。
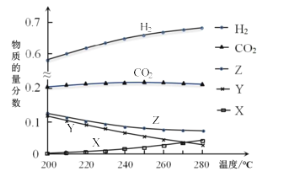
(4)①体系中CO2的物质的量分数受温度的影响不大,原因是_______________________。
②下列措施中,无法提高甲醇平衡产率的是________(填标号)。
A.加入适量CO B.增大压强C.循环利用原料气D.升高温度
③如上图X、Y分别代表_________、________(填化学式)。
III.利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
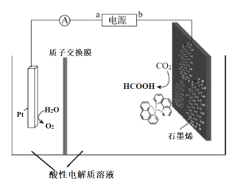
(5)①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”),阴极的电极反应式为________________。
②每转移2mol电子,阴极室溶液质量增加______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com