
对于相应化学用语的推论合理的是( )
选项 | 化学用语 | 推论 |
A |
| 该铀离子核外有89个电子 |
B | 2H2(g)+O2(g)= 2H2O(g);△H=-483.6kJ?mol | 1mol氢气完全燃烧放出热量483.6kJ. |
C | 2NaCl+2H2O | NaCl氧化性比Cl2强 |
D | FeO+4H++NO3―= Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
化学在工业生产和日常生活中都有着重要的应用,下列说法正确的是
A.活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色
B.Na2O2、H2O2所含化学键完全相同,都能作供氧剂
C.常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运
D.水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
(13分)【化学—物质结构与性质】
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
(1)N原子价电子轨道表示式 ;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是 ;PCl4+的空间构型是 ;
(3)PCl6-呈正八面体的结构(如图),该离子中 (填“是”或“否”)存在配位键,原因是 ;

(4)NCl3分子中,N原子杂化方式是 ;NCl3不稳定,易发生分【解析】
2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为 ;
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:选择题
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法不正确的是
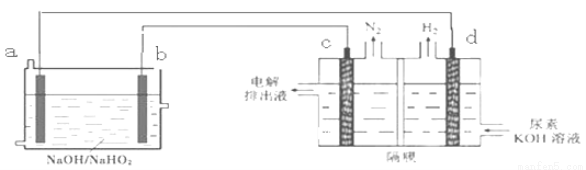
A.燃料电池的总反应为:2Al+3HO2- = 2AlO2- + OH- +H2O
B.电极b是正极,且反应后该电极区pH增大
C.电解过程中,电子的流向由a→b→c→d.
D.电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:填空题
(15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:
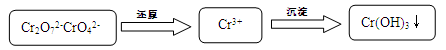
(1)加酸可以使CrO42-转化为Cr2O72-: 2CrO42- + 2H+ 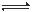 Cr2O72- + H2O
Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol?L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K= 。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为 。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH应升高到 。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的 极。
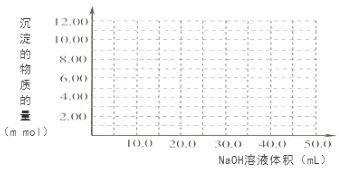
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为 。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:填空题
铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。
②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+ 中Cu+ 与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
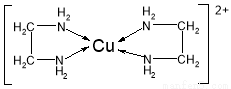
请回答下列问题:
①配离子[Cu(En)2]2+的中心原子基态第L层电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是: 。
③配合物[Cu(En)2]Cl2中不存在的作用力类型有 (填字母);
A 配位键 B 极性键 C 离子键 D 非极性键 E.氢键 F.金属键
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各组分子中,都属于含有极性键的非极性分子的一组是( )
A.CO2、H2O B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.离子晶体的晶格能越大,离子键越强
B.阳离子的半径越大则可同时吸引的阴离子越多
C.通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成的离子化合物的晶格能越大
D.拆开1mol离子键所需的能量叫该离子晶体的晶格能
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:选择题
下列对于与生产、生活有关的化学问题的分析正确的是( )
A.对“地沟油”进行分馏可得到汽油
B.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
C.误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶
D.PM 2.5、二氧化碳都属于空气质量日报的内容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com