
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
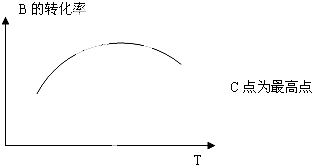
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Na+、Cl-、CO32- |
| D、K+、Cu2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯分子呈平面正六边形,六个碳碳键完全相同,键角皆为120° |
| B、苯分子中的碳原子采取sp2杂化,6个碳原子中未参与杂化的2p轨道以“肩并肩”形式形成一个大π键 |
| C、苯分子中的碳碳键是介于单键和双键之间的一种特殊类型的键 |
| D、苯能使溴水褪色,是因为苯将Br2还原为Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3和O2互为同位素 |
| B、O3比O2稳定 |
| C、等质量的O3和O2含有相同的原子数 |
| D、O3与O2的相互转变是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Be原子的结构示意图 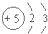 |
| B、乙醇的结构简式:C2H5OH |
| C、明矾的化学式KAlSO4?12H2O |
| D、乙烯的结构式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑥⑦⑧ | B、②③④⑥⑦ |
| C、③⑥⑧ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
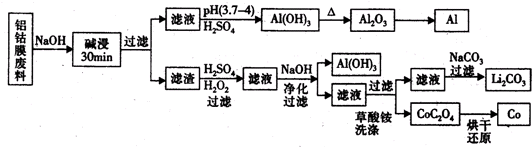
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com