
| ������� | ���� | ���� | ̼�� |
| ����ƽ�ⳣ����25�棩 | 1.8��10-5 | 1.28��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
| A��25��ʱ�������ʵ���Ũ�ȵ�������ҺpH��ϵΪ��pH��Na2CO3����pH��C6H5ONa����pH��NaHCO3����pH��CH3COONa�� |
| B����amol/L������bmol/LNaOH����Һ�������Ϻ���Һ��c��Na+��=c��C6H5O-������aһ������b |
| C��C6H5ONa��Һ��ͨ����CO2���壺2C6H5ONa+H2O=CO2��2C6H5OH+Na2CO3 |
| D��������CH3COOH��Na2CO3��Һ��ϣ�2CH3COOH+Na2CO3�T2CH3COONa+H2O+CO2�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AlO2- |
| B��Al3+ |
| C��Mg2+ |
| D��Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ˮ�м������NaOH��c��Na+��=c��Cl-��+c��ClO-��+c��OH-�� |
| B��pH=8.3��NaHCO3��Һ��c��Na+����c��HCO3-����c��H2CO3����c��CO32-�� |
| C��pH�T11�İ�ˮ��pH=3������������ϣ�c��Cl-��=c��NH4+����c��OH-��=c��H+�� |
| D��ͬŨ��ͬ�����ǿ����ǿ����Һ��Ϻ���Һ��pH=7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AgCl���ܽ������ |
| B��AgCl���ܽ�ȡ�Ksp������ |
| C��Ksp��AgCl������ |
| D��AgCl���ܽ�ȡ�Ksp������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����CH3COONa��Һ�м�������CH3COOH����ʹc��Na+��=c��CH3COO-�� |
| B��pH=3��CH3COOH��pH=11��NaOH��Һ�������Ϻ���Һ�Լ��� |
| C��������CuSO4��Һ��0.1mol?L-1��H2S��Һ�У�Cu2+�ܴﵽ�����Ũ��Ϊ1.3��10-35mol?L-1����֪��Ksp��CuS��=1.3��10-36�� |
| D����1molKOH����Һ��1molCO2��ȫ��Ӧ����Һ��c��K+��=c��HCO3-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
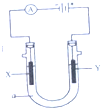 ��1���״���һ������ȼ�ϣ�������ȼ�ϵ�أ���ҵ�Ͽ����������ַ�Ӧ�Ʊ��״���
��1���״���һ������ȼ�ϣ�������ȼ�ϵ�أ���ҵ�Ͽ����������ַ�Ӧ�Ʊ��״����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������¶� |
| B������ѹǿ |
| C�������¶�ͬʱ����N2 |
| D����ʱ��CO2��N2�ӷ�Ӧ��ϵ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ԫ�ػ�̬ԭ���й���7������ |
| B����Ԫ��ԭ�Ӻ�����3�����Ӳ� |
| C����Ԫ��ԭ��M�ܲ㹲��5������ |
| D����Ԫ��ԭ������������1����2������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com