
| A. | HCl的电子式为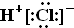 | B. | Cl-的结构示意图 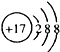 | ||
| C. | CO2的电子式 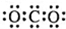 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
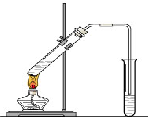 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 0.9 | C. | 0.45 | D. | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
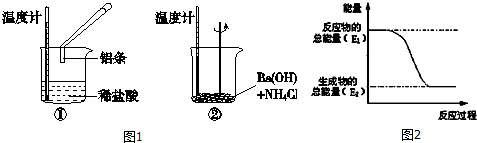
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com