
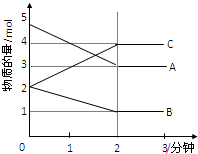
 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体). 2C,
2C, 2C;
2C;| 1mol |
| 5L?2min |
| 2mol |
| 5mol |


科目:高中化学 来源: 题型:
| A、b-a=m+n |
| B、X的原子半径大于Y |
| C、X的族序数小于Y |
| D、X不可能是氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇合成反应及其能量变化如图所示:
甲醇合成反应及其能量变化如图所示:| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4可由铁在氧气中缓慢氧化得到 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com