
����Ŀ���������˲����㣬�Ҿ���һ����Σ���ԣ�Ŀǰ��������������Խ��������Ʒ���������ش�
��1���ȼҵ���������Ļ�ѧ����ʽΪ ��
��2��84����Һ��������Ⱦ������˷�����ŵ㣬���������ռ���Һ��Ӧ�Ʊ�84����Һ�����ӷ���ʽΪ ��
��3������������Ŀǰ�����Ϲ��ϵ�����һ���ĸ�Ч�����ס���ȫ��ɱ�������ʼ����ҹ���ѧ���з��������������������ƣ�NaClO2�������Ʊ��������ȵķ������仯ѧ����ʽΪ ��
��4��һλͬѧ�����һ����Ũ�����KMnO4������ȡ�����������Ƚ�������ⵥ�ʵ�������ǿ������װ�ã���ͼ���� 
��������Һ������Cl2����������ĸ��ţ���
A������ʳ��ˮ B������Na2SO3��ҺC������NaOH��Һ D��Ũ����
����˵��Cl2��������ǿ��I2��ʵ�������� �� ��ԭ�ӽṹ�ǶȽ���Cl2��������ǿ��I2��ԭ�� ��
���𰸡�
��1��2NaCl+2H2O ![]() 2NaOH+Cl2��+H2��
2NaOH+Cl2��+H2��
��2��Cl2+2OH��=Cl��+ClO��+H2O
��3��Cl2+2NaClO2=2ClO2+2NaCl
��4��BC��ʪ����۵⻯����ֽ������ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶���α�õ����������μ����������������μ���
���������⣺��1���ȼҵ������������ⱥ��ʳ��ˮ����ӦΪ2NaCl+2H2O ![]() 2NaOH+Cl2��+H2�������Դ��ǣ�2NaCl+2H2O
2NaOH+Cl2��+H2�������Դ��ǣ�2NaCl+2H2O ![]() 2NaOH+Cl2��+H2������2�����������ռ���Һ��Ӧ�Ʊ�84����Һ������NaCl��NaClO��ˮ�����ӷ�ӦΪCl2+2OH��=Cl��+ClO��+H2O�����Դ��ǣ�Cl2+2OH��=Cl��+ClO��+H2O����3�������������������ƣ�NaClO2�������Ʊ��������ȣ�������NaCl����ӦΪCl2+2NaClO2=2ClO2+2NaCl�����Դ��ǣ�Cl2+2NaClO2=2ClO2+2NaCl����4����CΪ������Һ��B���л�ԭ�ԣ���BC�е����ʿ��������������Դ��ǣ�BC����˵��Cl2��������ǿ��I2��ʵ�飬��������KI���ɵ⣬ʹ����KI��ֽ��������ʪ����۵⻯����ֽ������˵��Cl2��������ǿ��I2 �� ����ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶���α�õ����������μ����������������μ��������Դ��ǣ�ʪ����۵⻯����ֽ������ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶���α�õ����������μ����������������μ�����
2NaOH+Cl2��+H2������2�����������ռ���Һ��Ӧ�Ʊ�84����Һ������NaCl��NaClO��ˮ�����ӷ�ӦΪCl2+2OH��=Cl��+ClO��+H2O�����Դ��ǣ�Cl2+2OH��=Cl��+ClO��+H2O����3�������������������ƣ�NaClO2�������Ʊ��������ȣ�������NaCl����ӦΪCl2+2NaClO2=2ClO2+2NaCl�����Դ��ǣ�Cl2+2NaClO2=2ClO2+2NaCl����4����CΪ������Һ��B���л�ԭ�ԣ���BC�е����ʿ��������������Դ��ǣ�BC����˵��Cl2��������ǿ��I2��ʵ�飬��������KI���ɵ⣬ʹ����KI��ֽ��������ʪ����۵⻯����ֽ������˵��Cl2��������ǿ��I2 �� ����ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶���α�õ����������μ����������������μ��������Դ��ǣ�ʪ����۵⻯����ֽ������ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶���α�õ����������μ����������������μ�����
�����㾫����������Ҫ�����������Ļ�ѧ���ʵ����֪ʶ�㣬��Ҫ���������Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������࣬�����������й���ģ������л���������ȷ���ǣ� ��
A.![]() 2���һ�����
2���һ�����
B.CH3CHBr2��������
C.![]() 2������ϩ
2������ϩ
D.![]() ���״�
���״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨ ![]() ����һ�ֶ��صĵ�ζ�����к�ǿ�ķ��������ʹ�Ч������������Ϊ��ɫҺ�壬����ˮ���Ҵ����ܣ�
����һ�ֶ��صĵ�ζ�����к�ǿ�ķ��������ʹ�Ч������������Ϊ��ɫҺ�壬����ˮ���Ҵ����ܣ�
��1����ͭ˿�ڿ���������������ʺ�ɫ���������������У�ͭ˿����ɫ��Ϊ �� ֤����������к����ǻ����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2�������ʵ��֤����������к����Ȼ��� ��
��3��[CH3CH��OH��COO]2Fe��������������һ�ֳ��õIJ���������ͨ��������̼��������Ӧ�Ƶã���ͼװ�ã����Ⱥͼг�װ����ȥ��A��װ��ϡ���ᣬ��ƿB��װ����м��������ƿC�м���̼�����������������Һ��������75�棬��A��ϡ�������B�п�ʼ��Ӧ�� 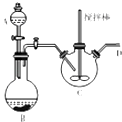
������A��B��ɵ�װ�õ������� ��
��C�з�����Ӧ�Ļ�ѧ����ʽΪ ��
�۸�ʵ����β�������ķ���Ϊ ��
��ij��ȤС����KMnO4�ζ����ⶨ��Ʒ��Fe2+�������������Ʒ����������������������������ֲ�Ʒ�������������Ǵ���100%����ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.NH4HSO3��������2 mol/L������Һ����ȣ������Ĵ̼�����ζ��������NH3
B.
����ͼ��ʾװ��̽��ͭ˿�����Ũ����ķ�Ӧ��Ϊȷ��CuSO4���ɣ�����м�ˮ���۲���ɫ
C.ȡ����������һ������ϡ����ǡ����ȫ��Ӧ���������Ե����������������Ե���������ʵ���֮��Ϊ3��1
D.��������Ȼ����Ʊ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������30mLͬһŨ�ȵ�NaOH��Һ��ͨ��CO2���壬��CO2ͨ�����IJ�ͬ����Һ�����Ҳ��ͬ���õ���ҺM��N������M��N��Һ����μ���Ũ��Ϊ0.25molL��1���ᣬ�������������v��CO2���������������v��HCl���Ĺ�ϵ�ֱ�Ϊ��ͼ��ʾ�������A��B��
��ش��������⣺
��1��NaOH��Һ�����ʵ���Ũ��Ϊ ��
��2��M��N����Һ����ͬ������ʵ����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������������������ȷ���ǣ�������
A.��״���£�22.4L H2����������������������Ϊ2NA
B.32g O2�����32g O3����ķ�����֮��Ϊ3��2
C.1L 1molL��1��������������������Ϊ2NA
D.71g�������������۳�ַ�Ӧ��ת�Ƶĵ�����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش�
��1�������������ʽ��ʾ���[NaAl��SiO3��2]����� ��
��2��þȼ�ղ�����CO2����û�ѧ����ʽ��ʾ������ ��
��3����NaHSO4��Һ�еμ�Ba��OH2����Һ����Һ�����ԣ��÷�Ӧ�����ӷ���ʽ ��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ�� �����ջ�����FeS2����
����֪��������Cl2��Br2��Fe3+ �� д��FeBr2��Һ������ʵ���Cl2��Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�Ƿ���ʽΪC7H8�ķ���������֪����������һϵ��ת����ϵ������C��һ��һԪ����D��A�Ķ�λһȡ���H��E��I��F�ֱ�Ϊͬ���칹�壺
��1��������I�Ľṹ��ʽ�� ��
��ӦB��C�Ļ�ѧ����ʽ��.
��2�����ʵ��֤��H�к�����ԭ�ӣ������õ����Լ���.
��3��Ϊ��֤E��F�ķ�Ӧ������E��G��ͬ������ʵ�鷽����ʵ���е���_____________��
A.��E��F��Ӧ��Ļ��Һ�м��������ữ���ټ���AgNO3��Һ�õ�����ɫ����
B.��E��F��Ӧ��Ļ��Һ�м�����ˮ��������ˮ������ɫ
C.��E��F��Ӧ��Ļ��Һ�м��������ữ�������CCl4��Һ��ʹ֮��ɫ
D.��E��F��Ӧ��Ļ��Һ�м�������KMnO4��Һ�����Һ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӣ���ش��������⣺
��1��Y��Ԫ�����ڱ��е�λ��Ϊ ��
��2������Ԫ�ص�����������Ӧ��ˮ����������ǿ������д��ѧʽ�����ǽ�����̬�⻯�ﻹԭ����ǿ������д��ѧʽ����
��3��Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ������������д�������������ʵĻ�ѧʽ����
��4��ZX�ĵ���ʽΪ��ZX��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com