
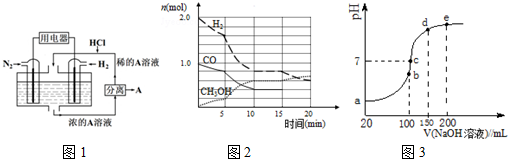
分析 (1)①已知CH4、H2的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1,可得热化学方程式为:
I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
Ⅱ.H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅱ×4-I可得:CO2(g)+4H2(g)=CH4(g)+2H2O(l);
②电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵;
(2)①10min到达平衡,利用三段式计算表示时各物质的量,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO),再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数;
②5min时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂;
(3)①若二者恰好反应得到CH3COONa溶液,溶液中CH3COO-水解呈碱性,反应后溶液pH=7,溶液就呈中性,故反应时醋酸应过量;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,由物料守恒可知c(CH3COOH)=0.5(a-b)mol/L,再根据电离常数Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$计算;
(4)①a、b、c、d、e五个点,根据反应量的关系,a点是100mL0.1mol•L-1NH4HSO4溶液的PH,b点是氢氧化钠和硫酸氢铵溶液中氢离子恰好反应,恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c点是溶液PH=7,呈中性;
②c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分.
解答 解:(1)①已知CH4、H2的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1,可得热化学方程式为:
I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
Ⅱ.H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅱ×4-I可得:CO2 (g)+4H2(g)=CH4(g)+2H2O(l)△H=-285.8kJ•mol-1×4+890.3KJ/mol=-252.9 kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9 kJ/mol;
②电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①由图可知10min到达平衡,平衡时甲醇为0.6mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.6 1.2 0.6
平衡量(mol):0.4 0.8 0.6
则v(CO)=$\frac{\frac{0.6mol}{2L}}{10min}$=0.03mol/(L.min),
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$=$\frac{75}{8}$,
故答案为:0.03mol/(L.min);$\frac{75}{8}$;
②5min时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂,
故答案为:反应受热或使用了催化剂;
(3)①若二者恰好反应得到CH3COONa溶液,溶液中CH3COO-水解呈碱性,反应后溶液pH=7,溶液就呈中性,故反应时醋酸应过量,则VmL×0.1000mol•L-1<20.00mL×0.1000mol•L-1,故V<20,
故答案为:<;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,由物料守恒可知c(CH3COOH)=0.5(a-b)mol/L,则CH3COOH的电离常数Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}×0.5b}{0.5(a-b)}$=$\frac{1{0}^{-7}b}{a-b}$,
故答案为:$\frac{1{0}^{-7}b}{a-b}$;
(4)①a、b、c、d、e五个点,a点是100mL0.1mol•L-1NH4HSO4溶液的PH,铵根离子水解显酸性,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,溶液中发生水解反应的离子是NH4+,NH4++H2O?NH3•H2O+H+,铵根离子水解溶液显酸性,
故答案为:NH4+;
②c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),则c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查化学平衡计算与影响因素、热化学方程式书写、电离平衡常数的计算、电解质溶液中离子浓度大小分析判断,注意图象的变化特征分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 电池放电后,溶液PH不断升高 | |
| C. | 负极上O2得到电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 负极上CH4失去电子,电极反应式:CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li原子的最外层电子数比Mg原子的最外层电子数少 | |
| B. | Mg原子的电子层数比Li原子电子层数多 | |
| C. | 1 mol Mg从酸中置换出的H2比1 mol Li从酸中置换出的H2多 | |
| D. | 氢氧化锂的碱性比氢氧化镁强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
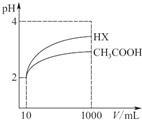 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | Cl>S>F>O | D. | S2->O2->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
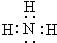 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com