
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是____。
(2)Fe(OH)3胶体制备的化学方程式为_____。
(3)证明有Fe(OH)3胶体生成利用的胶体性质是_____。
(4)利用Fe(OH)3胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带____(填“正”或“负”)电荷。
②若向其中加入浓盐酸溶液,产生的现象是_____,用必要的文字和有关的离子方程式解释此现象_____。
【答案】丙 FeCl3+3H2O=Fe(OH)3(胶体)+3HCl 丁达尔效应 正 有红褐色沉淀生成 有红褐色沉淀生成,继续加入沉淀会溶解(溶液变黄色),加盐酸时,先是胶体在电解质作用下发生聚沉产生红褐色Fe(OH)3沉淀,然后继续加盐酸,Fe(OH)3沉淀溶解:Fe(OH)3+3H+=Fe3++3H2O,生成氯化铁棕黄色溶液
【解析】
(1)(1)甲同学向1molL-1氯化铁溶液中加入少量的NaOH溶液,会发生复分解反应生成红褐色沉淀,乙同学直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀,制备氢氧化铁胶体的方法:向25mL沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,故答案为:丙;
(2)Fe(OH)3胶体制备的化学方程式为:![]() ,
,
故答案为:![]() ;
;
(3)丁达尔效应是胶体的特有性质,可用来鉴别胶体,
故答案为:丁达尔效应;
(4)①胶体具有电泳性质,电泳实验证明了胶体胶粒带电,胶粒向负极移动,说明Fe(OH)3胶粒带正电,
故答案为:正;
②加入浓盐酸是电解质溶液,会引起氢氧化铁胶体聚沉,继续加入浓盐酸,氢氧化铁沉淀会溶解,加盐酸时,先是胶体在电解质作用下发生聚沉产生红褐色Fe(OH)3沉淀,然后继续加盐酸,Fe(OH)3沉淀溶解,生成硫酸铁棕黄色溶液。


科目:高中化学 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的镁条7.2 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
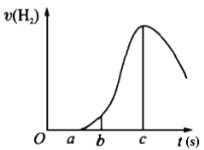
(1)曲线由0→a段不产生氢气的原因________,有关的离子方程式为______________;
(2)曲线由b→c段,产生氢气的速率逐渐增大的主要原因________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因________________。
(4)在b到c这段时间内,收集到氢气V L(标准状况),则这段时间内用硫酸表示的平均速率为________mol/(L·s)(假设反应前后溶液体积不变)。
(5)对于足量镁条和100 mL 2 mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是________。
①加NaOH固体;②加BaCl2溶液;③加KNO3溶液;④加H2O;⑤加CH3COONa固体;⑥加小苏打溶液;⑦加少量CuSO4溶液;⑧加Na2SO4溶液;⑨将2 mol/L硫酸换成160 mL 2.5 mol/L的盐酸;⑩将镁条换成镁粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:浓硫酸易使有机物脱水,如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯时温度计水银球位置应在反应液的液面下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
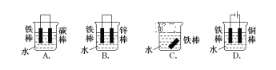
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀___________。
(2)实际生产可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图.请回答:
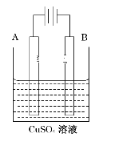
①A电极对应的金属是________(写元素名称),B电极的电极反应式是_________。
②镀层破损后,镀铜铁和镀锌铁中更容易被腐蚀的是___________。
A 镀铜铁 B 镀锌铁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~L分别代表中学化学中的常见物质(部分反应的条件已略去)。A是一种常见氮肥,摩尔质量为79 g·mol-1。常温下,C是无色液体,E、L为常见金属单质,B、G、I、J、K为气体,其中D能使澄清的石灰水变浑浊,K呈红棕色。F为有磁性的黑色固体。
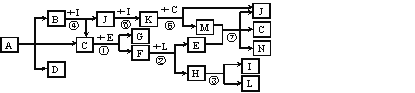
(1)A的化学式为____。
(2)写出反应④的化学方程式:____。
(3)写出反应①的化学方程式:____。
(4)若反应⑦中物质E过量,写出该反应的离子方程式:____。
(5)气体B或K直接排放到空气中会污染环境,在催化剂作用下两者会反应生成对环境无害的物质。写出该反应的方程式,并用单线桥表示电子转移的方向和数目:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项 | 实验目的 | 仪器 |
A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
B | 除去氢氧化铝胶体中的泥沙 | 半透膜、烧杯、玻璃棒 |
C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 中和热的测定 | 烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com