
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_____________ (填“正极”或“负极”),负极的电极反应式为________________________________________ 。
(2)石墨电极为__________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,__________ 区(填“铁极”或“石墨极”)的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________________,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为_______________________。
(4)若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_________L;丙装置中阴极析出铜的质量为 ____________g 。
【答案】正极 CH3OCH3-12e-+16OH-═2CO32-+11H2O 阳极 铁极 减少 Cu2+ + 2e- = Cu 0.448 1.28
【解析】
(1)原电池中,正极发生还原反应,负极发生氧化反应,负甲醚失去电子被氧化生成碳酸根离子;
(2)铁电极连接原电池的负极,为电解池的阴极,阴极上氢离子放电;
(3)根据转移电子守恒,阳极上铜消耗的质量小于阴极上析出铜的质量,所以溶液中硫酸铜浓度减小;
(4)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2~2H2~2Cu进行计算。
(1)燃料电池中通入氧化剂氧气的电极是正极,正极上得电子发生还原反应,负极上通入的是甲醚,负极上燃料失电子和氢氧根离子发生氧化反应生成碳酸根离子和水,电极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O,故答案为:正极;CH3OCH3-12e-+16OH-═2CO32-+11H2O。
(2)铁电极连接原电池负极而作电解池阴极,碳作阳极,电解氯化钠饱和溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,阴极上氢离子放电,电极方程式为:2H2O+2e-=2OH-+H2↑,滴入酚酞溶液,铁电极区的溶液先变红,
故答案为:阳极,铁极。
(3)丙装置中,如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失去电子进入溶液,阴极上析出铜离子,阳极上金属失电子发生氧化反应,电极方程式为:Cu2++2e-=Cu,阴极上铜离子得电子生成铜,根据转移电子守恒,阳极上铜消耗的质量小于阴极上析出铜的质量,所以溶液中硫酸铜浓度减小,故答案为:减少,Cu2++2e-=Cu。
(4)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2~2H2~2Cu。若在标准状况下,有224mL的氧气参加反应,乙装置中铁电极上氢离子放电生成氢气,则乙装置中铁电极上生成氢气的体积=0.224L×2=0.448L,丙装置中阴极上铜离子得电子生成铜单质,析出铜的质量=0.224L/22.4L/mol×2×64g/mol=12.8g,
故答案为:0.448L,12.8g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组物质性质的比较,结论正确的是(____________)
A. 分子的极性:![]() B. 物质的硬度:
B. 物质的硬度:![]()
C. 物质的沸点:![]() D.在
D.在![]() 中的溶解度:
中的溶解度:![]()
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)![]() 位于元素周期表中第四周期____族,基态
位于元素周期表中第四周期____族,基态![]() 原子核外未成对电子有_____个。
原子核外未成对电子有_____个。
(2)![]() 可与
可与![]() 反应生成
反应生成![]() ,新生成的化学键为_____键。
,新生成的化学键为_____键。![]() 分子的空间构型为______,其中N原子的杂化轨道类型为_______。
分子的空间构型为______,其中N原子的杂化轨道类型为_______。
(3)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm, ![]() 中锰的原子半径为_____pm。已知阿伏加德罗常数的值为
中锰的原子半径为_____pm。已知阿伏加德罗常数的值为![]() ,
, ![]() 的理论密度
的理论密度![]() ____
____![]() 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____,其配位数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡: K2SO4·MgSO4·2CaSO4(s)![]() 2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是
2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是

A. 向该体系中分别加入饱和NaOH溶液和饱和碳酸钠溶液,沉淀溶解平衡均向右移动
B. 分析可知T1>T2>T3
C. 升高温度,溶浸速率增大,平衡向右移动
D. 该物质的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)/c(K2SO4·MgSO4·2CaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl![]() NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2OD.NH3+CO2+H2O=NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A. 钢铁吸氧腐蚀中的正极反应:4OH--4e-=2H2O +O2
B. 由Na和Cl形成离子键的过程:![]()
C. NaHCO3的水解平衡:HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
D. 实验室制乙炔的反应:CaC2+H2O →CaO+C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。
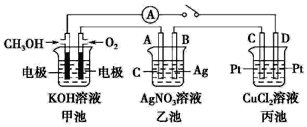
请回答下列问题:
(1)甲池为原电池,通入 CH3OH 电极的电极反应为________。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为_____。
(3)当乙池B极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池D极析出_____g 铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到______(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______作指示剂.
(3)读取盛装0.1000mol/L KOH溶液的_________(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为________mL.

(4)滴定:当_______时,停止滴定,并记录KOH溶液的终点读数.重复滴定3次.
Ⅱ.实验记录:
实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(KOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=______g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是____(填写序号)。
A.碱式滴定管在滴定时未用标准KOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com