
| A、33% | B、40% |
| C、50% | D、66% |
| 2 |
| 3 |
| ||
| 1mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
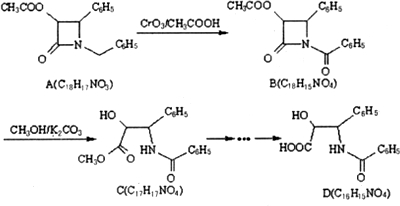
| K2CO3 |
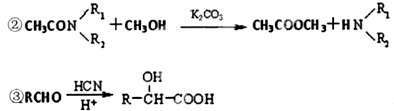
| PCl3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
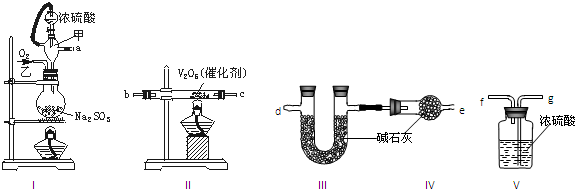
查看答案和解析>>
科目:高中化学 来源: 题型:
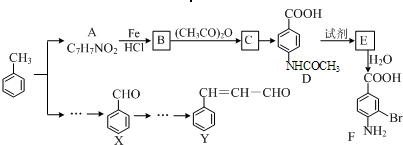

| NaOH |
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁是地壳中含量最多的金属元素 |
| B、铁是人类使用最早的金属 |
| C、纯铁是银白色金属 |
| D、铁能在氧气中燃烧,但不能与高温水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应体系的压强,平衡时A的转化率不变 |
| B、反应从开始至达到平衡时,用C、D表示的反应速率之比为3:2 |
| C、若反应的容积不变,反应过程中气体的密度不发生改变 |
| D、在相同温度、相同体积的甲容器里加入1molA、4molB,乙容器里加入5mol C、2mol D,反应达到平衡时,两容器中D的体积分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气在氯气中燃烧产生苍白色火焰 |
| B、金属钠长期暴露在空气中变成黄色 |
| C、钠在氯气中燃烧产生白烟 |
| D、过氧化钠投入水中生成的气体能使带火星的木条复燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
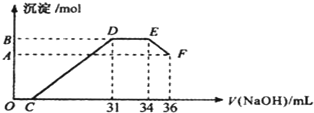
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com