
| ||
| ||


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�������ľ�����ͼ��ʾ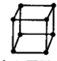 ������λ��Ϊ8 ������λ��Ϊ8 | ||||||||
| B��SO2�����У�Sԭ�ӵļ۲���Ӷ���Ϊ3������ԭ���Ϲµ��Ӷ���Ϊ1��Sԭ��Ϊsp3�ӻ�����ֱ���ͷ��� | ||||||||
| C����������Һ������Ũ�ȵĹ�ϵΪ��c��Na+����c��CH3COO-����c��H+����c��OH-�� | ||||||||
D����֪��Ӧ2CH3OH��g��?CH3OCH3+H2O��g����ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£��ں����ܱ������м���һ����CH3OH��ijʱ�̲�ø����Ũ�����±������ʱ�����淴Ӧ���ʵĴ�С��ϵΪ��v����v��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�pHС��7 |
| B�����ڹ�ϵʽ��c��H+��=2c��S2-��+c��HS-��+c��OH-�� |
| C��25��ʱ����ˮ���������c��H+����1��10-7mol?L-1 |
| D������Һ�м�������NaOH���壬c��S2-������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
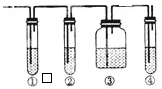 ʵ������ͨ����Ũ����ʹ�Ҵ���ˮ��ȡ������ϩ����Ӧ������Ϊ��CH3CH2OH��C2H4��+H2O��ʵ���г����¶ȹ���ʹ�Ҵ���Ũ���ᷴӦ���������Ķ����������壮�����������ͼ��ʵ�飬��ȷ����������������Ƿ�����ϩ�Ͷ�������
ʵ������ͨ����Ũ����ʹ�Ҵ���ˮ��ȡ������ϩ����Ӧ������Ϊ��CH3CH2OH��C2H4��+H2O��ʵ���г����¶ȹ���ʹ�Ҵ���Ũ���ᷴӦ���������Ķ����������壮�����������ͼ��ʵ�飬��ȷ����������������Ƿ�����ϩ�Ͷ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
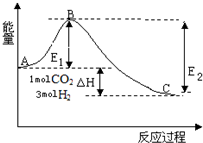 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com