
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
分析 丙酸结构简式为CH3CH2COOH,含有羧基,具有羧酸性质,
A.丙酸属于酸,能使紫色石蕊试液变红色;
B.酯化反应都是取代反应;
C.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物;
D.羧酸不存在羧酸类同分异构体.
解答 解:A.丙酸属于酸,能电离出氢离子而能使紫色石蕊试液变红色,故A正确;
B.酯化反应都是取代反应,所以丙酸和乙醇的酯化反应属于取代反应,故B正确;
C.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物,丙酸和乙酸相差一个-CH2原子团,所以属于同系物,故C正确;
D.羧酸不存在羧酸类同分异构体,但含有酯类同分异构体,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系及基本概念即可解答,注意酯的水解反应、酯化反应都属于取代反应,易错选项是D.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.| 反应温度 | 300℃ | 400℃ | 500℃ | 600℃ | 700℃ |
| 平衡常数 | 3.8 | 5.7 | 8.5 | 9.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用可降解塑料聚二氧化碳,能减少白色污染 | |
| B. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| C. | 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| D. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
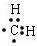 ;
;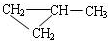 ;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
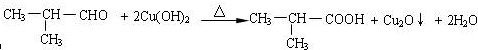 ;
; .
.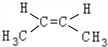 、
、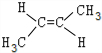 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 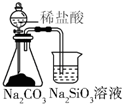 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 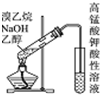 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 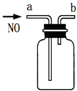 用此图装置收集一瓶纯净的NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
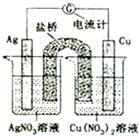 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g| 温度T | T1 | T2 | T3 |
| 平衡常数K | 1.2 | 2.5 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com