
下列离子反应不能发生的是( )
A.KHCO3+HCl===KCl+CO2↑+H2O
B.AgNO3+NaCl===AgCl↓+NaNO3
C.Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
D.2HCl+Na2SO4===2NaCl+H2SO4
科目:高中化学 来源: 题型:
(1)沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445 kJ热量,热化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在5 mL 0.05 mol·L-1的某金属氯化物的溶液中,滴加0.1 mol·L-1 AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如下图所示,则该氯化物中金属元素的化合价为( )。
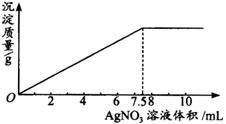
A.+l B.+2 C.+3 D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中的杂质(括号内为杂质),所加试剂或采用的提纯方法正确的是( )。
A.NaCl固体(Na2CO3固体):加水过滤
B.KNO3溶液(NaCl):过滤
C.CO2(HCl):通入Ca(OH)2溶液中
D.CuSO4溶液(Cu粉):过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中,可大量共存的离子组是( )
A.Na+、HCO3-、SO42-、Br-
B.Cu2+、NO3-、Cl-、SO42-
C.H+、Cl-、K+、CO32-
D.K+、Mg2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有HCO3-、Cl-、SO42-、NO3-、CO32-等阴离子。
(1)当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是________________________。
(2)当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g C.1000mL,117g D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
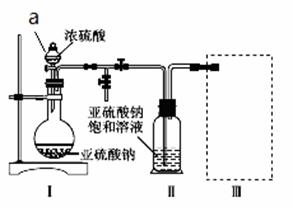
(1)a仪器的名称为: ,实验前要进行 。
装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)浓硫酸 (能或不能)用稀硫酸代替,原因是 。
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
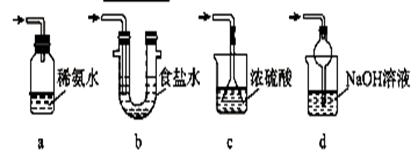
(4)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com