
已知450℃时,反应2HI(g) 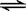 H2(g)+I2(g)的K=0.02,由此推测在
H2(g)+I2(g)的K=0.02,由此推测在
450℃时,反应H2(g)+I2(g) 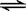 2HI(g)的化学平衡常数为
2HI(g)的化学平衡常数为
A.0.02 B.50 C.100 D.无法确定
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是 ( )
①Na2CO3 ②NaHCO3 ③Al2O3 ④Al(OH)3
A.①②③④ B.①②③ C.①②④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
用下图所示装置检验乙烯时不需要除杂的是( )
| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置可用于收集气体X并验证其某些化学性质,你认为正确的是( )
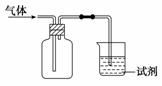
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 酸性KmnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | 能发生加成反应x k b 1 |
| C | X | 澄清石灰水 | 溶液变浑浊 | X不一定是CO2 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Cl2、NH3、NO2是中学化学中常见的气体,Cl2在一定条件下可与NH3、NO2反应,NH3和NO2在一定条件下也可反应。某校化学兴趣小组设计如下实验探究它们的性质。试回答下列问题:
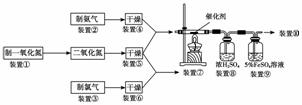
(1)实验室制一氧化氮的离子反应方程式为________________________,实验室制氨气的化学方程式为___________________________________________________________
________________________________________________________________________。
(2)装置④⑤⑥所用的仪器和药品能否完全相同______(填“能”或“否”)。
(3)装置⑧中导管紧贴液面,没有插到液面以下的原因是________________________,装置⑨的作用可能是__________________________________________________________
________________________________________________________________________。
(4)室温下,取干燥的Cl2和NO2的混合气体5 L于装置⑦中,当Cl2所占的体积分数分别为20%(Cl2完全反应)、60%(NO2完全反应)时,一段时间后装置⑦中气体的体积均为4 L。经测定4 L气体中除未反应气体外,只有一种新的气体化合物,则该化合物的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有热化学方程式:SO2(g)+ 1/2O2(g)==SO3(g) △H =-98.32kJ/mol现有5molSO2参加反应,当放出393.28kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: (1)Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)== Ag2O(s);ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B.-379.3kJ/mol
C.-332.8 kJ/mol D.+317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
N2O4的转化率越高
NO2的产量越大
N2O4与NO2的浓度之比越大
正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施
 增大N2O4起始浓度
增大N2O4起始浓度
向混合气中通入NO2
(C) 使用高效催化剂
(D) 升高温度
(6)如图是80℃时容器中N2O4浓度的变化
图,请在该图中补画出该反应在60℃反
应时N2O4浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
在配制溶液时,为防止溶液浑浊,需加入某一溶液,下列各组溶液配制时所加溶液(括号内为溶质)正确的是( )
A.Fe2(SO4)3(HCl) B.Na2CO3(NaOH)
C.AlCl3(H2SO4) D.CH3COONa(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com