
| A. | ④⑤ | B. | ①② | C. | ①②③⑤ | D. | ①②③④ |
分析 降低氢离子浓度、降低温度都能减缓化学反应速率,不影响生成氢气总量时,硫酸中的氢离子必须完全生成氢气,据此分析解答.
解答 解:①加入醋酸钠固体,醋酸钠和硫酸反应生成醋酸和硫酸钠,醋酸是弱电解质,氢离子浓度降低,反应速率减缓,且硫酸电离出的氢离子物质的量等于醋酸最终电离出的物质的量,所以生成氢气总量不变,故正确;
②加入水,氢离子浓度降低,反应速率减缓;但氢离子物质的量不变,所以生成氢气总量不变,故正确;
③加入硫酸钾固体,氢离子浓度不变,化学反应速率不变,故错误;
④加入硝酸钾固体,相当于含有硝酸,硝酸和新反应生成氮氧化物而不是氢气,故错误;
⑤加入固体铜,Zn、Cu和稀硫酸构成原电池而加速反应速率,故错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度对化学反应速率影响原理是解本题关键,注意加入硝酸钾固体后会生成氮氧化物,为易错点.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 正戊烷分子中所有原子均在一条直线上 | |
| D. | CH3CH(CH3)2在光照下与氯气反应,可以生成四种一氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 青霉素有解热镇痛的作用 | |
| C. | 阿司匹林是最重要的抗生素 | |
| D. | 随着药物的普及,生病了都可以到药店自己买药吃,不用到医院 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 2mol | C. | 1mol | D. | 3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果XCl2I2分子呈正方形结构,则没有同分异构体 | |
| B. | 如果XCl2I2分子呈正方形结构,则不可能为极性分子 | |
| C. | 如果XCl2I2分子呈四面体结构,则为极性分子 | |
| D. | 如果XCl2I2分子呈四面体结构,则有2种手性异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
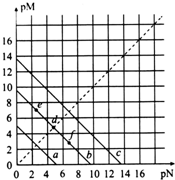 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀 | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com