
| A、蛋白质、葡萄糖和乙酸均属电解质 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |


科目:高中化学 来源: 题型:
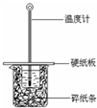 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示. | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.3 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.0 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.6 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | A13+、Ba2+、Ag+ |
| 阴离子 | C1-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
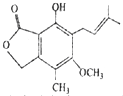
| A、该有机物的分子式为C15H18O4 |
| B、1mol该化合物最多可以与2molNaOH反应 |
| C、既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D、既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、②⑥⑧ |
| C、①④⑥ | D、全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
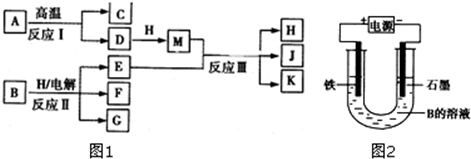
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2v(NH3)=v(CO2) |
| B、密闭容器中c(NH3):c(CO2)=2:1 |
| C、密闭容器中混合气体的密度不变 |
| D、密闭容器中氨气的体积分数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com