
| 组号 | 反应温度 /℃ | 参加反应物质 | ||||
| KMnO4 | H2C2O4 | MnSO4 | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | m/g | ||
| A | 20 | 4 | 0.1 | 2 | 0.1 | 0 |
| B | 20 | 4 | 0.1 | 2 | 0.1 | 0.1 |
| C | 40 | 4 | 0.1 | 2 | 0.1 | 0 |
| D | 40 | 4 | 0.1 | 2 | 0.2 | 0.1 |
| A. | A | B. | B | C. | C | D. | D |
分析 无论该反应是放热反应还是吸热反应升高温度都能加快化学反应速率;其它条件相同时,反应物的浓度越大反应速率越快;其它条件一定时,催化剂能加快反应速率,缩短反应的时间.
解答 解:根据表格分析:当其它条件一定时,无论该反应是放热反应还是吸热反应升高温度都能加快化学反应速率,温度越高反应速率越大,所以40℃的反应速率大于20℃的反应速率;当其它条件一定时,反应物的浓度越大反应速率越快,所以应选取草酸浓度最大的;当其它条件一定时,正催化剂能加快反应速率,硫酸锰能作该反应的催化剂,故选D.
点评 本题考查了外界条件对化学反应速率的影响,难度不大,注意无论该反应是放热反应还是吸热反应升高温度都能加快化学反应速率.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. | 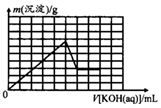 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
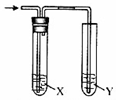 用图所示装置进行相关实验,能达到实验目的是( )
用图所示装置进行相关实验,能达到实验目的是( )| 实验 | 试剂X | 试剂Y | |
| A | 检验乙醇与浓硫酸共热产生的乙烯 | NaHSO3溶液 | KMnO4酸性溶液 |
| B | 检验CO2和SO2混合气体中的CO2 | 品红溶液 | 澄清的石灰水 |
| C | 除去Cl2中混有的HCl,并验证Cl2的漂白性 | 饱和NaCl溶液 | 品红溶液 |
| D | 通入 HCl,验证非金属性Cl>C>Si | NaHCO3溶液 | Na2 SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
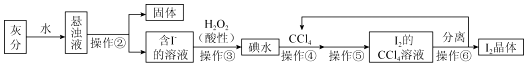
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离度 | B. | c(H+) | C. | 电离平衡常数K碱 | D. | c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种紫色重要的化工原料 | |
| B. | 钠和钾的合金在常温下是固体 | |
| C. | 用二氧化硅具有很强的导光能力,可用于制作光缆 | |
| D. | 发酵粉中含有碳酸钠,能使焙制出的糕点疏松多孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的命名为:2-甲基-3-乙基丁烷 | |
| B. | 分子式为 C4H8O2的酯有 4 种 | |
| C. | 乙烯分别使溴水和酸性 KMnO4 溶液褪色,反应类型相同 | |
| D. | 油脂是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com