
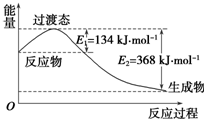
 (1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
分析 (1)根据盖斯定律,①-③-④可得:C(s)+H2O(g)═CO(g)+H2(g),反应热也进行需要计算;
(2)由图可知,1摩尔NO2和1摩尔CO完全反应生成CO2和NO放出热量为(368-134)kJ=234kJ,注明物质聚集状态与反应热,书写热化学方程式;
(3)反应热=反应物总键能-生成物总键能.
解答 解:(1)已知:C(s)+O2(g)═CO2(g)△H=E1 ①
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=E3 ③
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=E4 ④
根据盖斯定律,①-③-④可得:C(s)+H2O(g)═CO(g)+H2(g),故E2=E1-E3-E4,
故答案为:E1-E3-E4;
(2)由图可知,1摩尔NO2和1摩尔CO完全反应生成CO2和NO放出热量为(368-134)kJ=234kJ,反应热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1;
(3)反应热=反应物总键能-生成物总键能,故反应:H2(g)+Cl2(g)═2HCl(g)的焓变△H=436kJ/mol+247kJ/mol-2×434kJ/mol=-185kJ/mol,
故答案为:-185 kJ/mol.
点评 本题考查反应热有关计算、热化学方程式书写,难度不大,侧重对基础知识的巩固.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
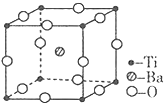 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的氢化物的沸点低于R的同族元素的氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
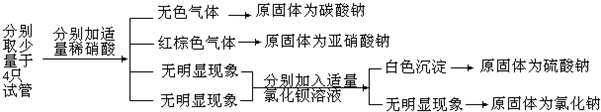 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
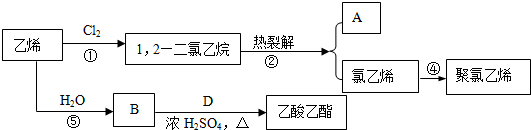
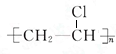 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
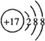 .
.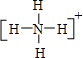 ,其中心原子以sp3杂化轨道成键.
,其中心原子以sp3杂化轨道成键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com