
分析 (1)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位;
(2)结合上述写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(3)依据反应产生的物质性质分析判断.
解答 解:(1)已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量,1mol液态肼和足量双氧水反应生成氮气和水蒸气时放出641.63KJ的热量;肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
②H2O(g)=H2O(l)△H=-44KJ/mol;
依据盖斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.63KJ/mol;
化学方程式中32g全部反应放热817.63KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408.815KJ,
故答案为:408.815;
(3)还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,除释放大量热量和快速产生大量气体外,还有很突出的优点是,产物为氮气和水,无污染,故答案为:产物为氮气和水,无污染.
点评 本题考查了热化学方程式的书写方法和注意问题,盖斯定律的应用,热化学方程式的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl>BaCl2>金刚石>S>Hg | B. | 金刚石>BaCl2>NaCl>S>Hg | ||
| C. | 金刚石>NaCl>BaCl2>S>Hg | D. | 金刚石>BaCl2>NaCl>Hg>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 棉、丝、毛、油脂都是天然有机高分子化合物 | |
| D. | 石油裂化的目的是得到乙烯、丙烯等化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: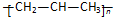 | B. | 二氧化碳的电子式: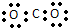 | ||
| C. | 乙酸的分子式:CH3COOH | D. | 中子数为18的硫原子:3416S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VIIA族元素的非金属性:F>Cl,所以VIIA族元素氢化物的酸性:HF>HCl | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,所以第三周期元素氢化物稳定性:HCl>H2S | |
| C. | 第二周期主族元素最外层电子数从1递增至7,所以第二周期主族元素的最高化合价也从+1递增至+7 | |
| D. | 工业制取金属钾的反应为:KCl (1)+Na (1)$\frac{\underline{\;850℃\;}}{\;}$NaCl(1)+K(g),所以金属性:Na>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1 mol•L-1的Fe2(SO4)3 溶液加热蒸干得到Fe(OH)3胶体粒子的数目为2NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com