
【题目】分子式为C5H10O的醛类物质,其同分异构体有
A. 3种 B. 4种 C. 5种 D. 6种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
X、Y、Z、Q、R、T是前四周期原子序数依次增大的六种元素,其中X元素形成的气体单质密度最小,Y元素氢化物的水溶液呈碱性,Z、R元素最外层电子数相同且Z的原子序数为R的一半,Q的原子半径在第三周期中最大,T是目前应用最广泛的金属。回答下列问题:
(1)T在周期表中的位置是 ,其M层上的电子排布式为 。
(2)Y、Z、R的第一电离能由大到小的顺序为 (用元素符号表示)。
(3)根据等电子体原理,Y2Z分子的结构式为 。
(4)YZ能被TRZ4溶液吸收生成配合物[T(YZ)(X2Z)5]RZ4,该配合物中含有的化学键类型有 ,RZ42-离子中R原子的杂化方式为 。
(5)由Q与Z、R可形成多种化合物,写出Q2Z2的电子式: ,Q2Z熔点比Q2R高,其原因是 。
(6)QX晶体的结构与NaCl相同,则X-的配位数为 ,若Q+与最邻近X-的核间距离为a pm,阿伏加德罗常数为NA,则QX晶体的密度为 g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
A. △H1>△H2>△H3
B. △H1>△H2=△H3
C. △H1<△H2<△H3
D. △H1=△H2<△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,某些弱酸的电离平衡常数如下表。下列说法正确的是

A. 向漂白粉溶液中加入少量NaHSO3可增强漂白性
B. Na2CO3溶液中通入少量SO2发生反应的离子方程式为:2C032-+SO2+H2O=2HCO3-+S032-
C. 相同浓度的NaC1O、Na2CO3、NaHCO3溶液的pH值由大到小的顺序为:NaClO>Na2C03>NaHC03
D. 相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存,并且溶液为无色透明的是( )
A.K+、Ca2+、HCO3-、Cl- B.Cu2+、Na+、NO3-、Cl-
C.Na+、K+、Mg2+、SO42- D.Mg2+、Fe3+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消毒,其制备反应为:CH3COOH+H2O2![]() CH3COOOH+H2O,下列有关说法正确的是
CH3COOOH+H2O,下列有关说法正确的是
A. 增大压强可加快该反应速率
B. 加入合适的催化剂可改变该反应的反应热
C. 达到平衡时,用任意组分表示正逆反应速率都有v(正)=v(逆)
D. 达到平衡时,H2O2转化率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJmol-1
C3H8(g)+5O2(g) = 3CO2(g)+4H2O(l) ΔH=-2220 kJmol-1
则H2的燃烧热为_______________________,1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(2)一定温度下,在4L密闭容器内某一反应中气体M,气体N的物质的量随时间变化的曲线如图所示:
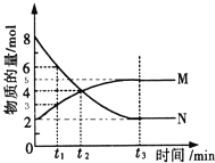
① 若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:__________________;
② t3时刻化学反应达到平衡时反应物的转化率为____________;
③ 如果升高温度则v逆 ________(填增大、减小或不变).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com