
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 蒸馏法淡化海水的过程中一定发生了化学变化 | |
| C. | 从海水中可以获得MgCl2,电解熔融MgCl2可制备Mg | |
| D. | 可以用分液的方法将海水淡化 |
分析 A.根据能量转化的方式分析;
B.蒸馏过程利用的是沸点不同,不属于化学变化;
C.电解熔融氯化镁生成镁和氯气;
D.分液操作用于分离互不相溶的液态混合物,分液操作无法将海水淡化.
解答 解:A、利用朝汐发电是朝汐能转化为电能,没有发生化学反应,而化学能转化为电能必须要发生化学反应,故A错误;
B.海水中含有氯化钠,经过海水蒸发制得氯化钠,只发生了物理变化,没有发生化学变化,故B错误;
C.从海水中得到氯化镁后,可以电解熔融状态的氯化镁生成氯气和金属镁,故C正确;
D.分液操作是分离互不相溶的液态混合物的方法,所以无法用分液的方法将海水淡化,故D错误;
故选C.
点评 本题考查了海水资源及其综合应用,题目难度中等,明确海水淡化的原理为解答关键,注意掌握电解原理、化学反应与能力变化,试题培养了学生的分析能力及灵活应用能力.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 | |
| B. | 该反应从电子转移角度看,每生成6mol铜,转移电子12mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应中,氧元素氧化了硫元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 | |
| D. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
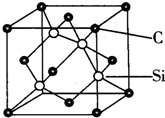 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: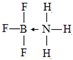 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
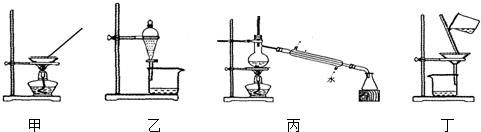
| A. | 可用甲装置蒸发氯化铵溶液制氯化铵 | |
| B. | 可用乙装置加水分离碘酒中的碘 | |
| C. | 可用丙装置分离乙醇和水 | |
| D. | 可用丁装置分离FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
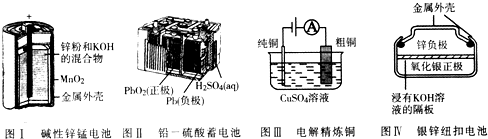
| A. | 图I所示电池中,锌极电极反应为Zn-2e-═Zn2+ | |
| B. | 图Ⅱ所示电池放电过程中,每转移1mo1电子,生成1mol PbSO4 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图Ⅳ所示电池中,Ag2O在电池工作过程中被氧化为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Na+、MnO4-、NO3-、Br- | |
| B. | 0.1 mol•L-1CaCl2溶液中:Mg2+、NH4+、CO32-、SO42- | |
| C. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
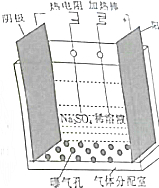 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com