
| A. | 铝用于制造电缆 | B. | 硝酸用于制造化肥 | ||
| C. | 常温下用铁制容器盛装浓硫酸 | D. | 四氧化三铁用作红色油漆 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O所含有的原子数为NA | |
| B. | 常温常压下,11.2LCl2所含的分子数为0.5NA | |
| C. | 常温常压下,32g O2含有的氧原子数为2NA | |
| D. | 1L0.1mol/LNa2SO4溶液中所含的Na+为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
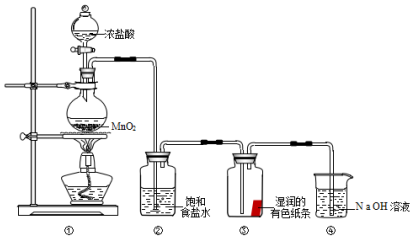
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
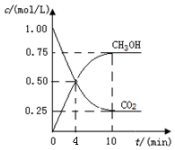 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用烧杯盛氢氧化钠称量 | |
| B. | 浓硫酸溶解后立即转移到容量瓶内 | |
| C. | 用量筒量硫酸时俯视刻度 | |
| D. | 用量筒量硫酸时,倾倒后量筒没有洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 烧碱的分子式为NaOH | |
| B. | 中子数为15的硅原子:${\;}_{14}^{20}$Si | |
| C. | 乙醇的结构简式:C2H5OH | |
| D. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com