
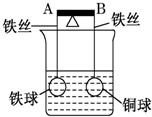
 ��ͼ�ܸ�AB���˷ֱ���������ͬ������ͬ�Ŀ�������Ϳ���ͭ���ڸܸ�ʹ�䱣��ƽ�⣬һ��ʱ���С�ļ���ŨCuSO4��Һ���ش������й����⣨��������˿��Ӧ������ĸ����仯��
��ͼ�ܸ�AB���˷ֱ���������ͬ������ͬ�Ŀ�������Ϳ���ͭ���ڸܸ�ʹ�䱣��ƽ�⣬һ��ʱ���С�ļ���ŨCuSO4��Һ���ش������й����⣨��������˿��Ӧ������ĸ����仯������ ��1�����ܸ�Ϊ��Ե��ʱ��ֻ����Fe������ͭ��Һ�ķ�Ӧ��
��2�����ܸ�Ϊ����ʱ�����ձ��������ŨCuSO4��Һ������Fe��Cuԭ��أ�FeΪ����������Fe-2e-�TFe2+��CuΪ����������Cu2++2e-�TCu��
��3�����ܸ�Ϊ����ʱ��FeΪ����������Fe-2e-�TFe2+��CuΪ����������Cu2++2e-�TCu����ͨ���ܸ˵�����Ϊ0.1NA�����ܽ����Ϊ0.05mol��������ͭΪ0.05mol���Դ������
��� �⣺��1�����ܸ�Ϊ��Ե��ʱ��ֻ����Fe������ͭ��Һ�ķ�Ӧ����Fe�ı��渽��Cu�����������A�˵ͣ�B�˸ߣ�������Ӧ�����ӷ���ʽΪFe+Cu2+�TFe2++Cu���ʴ�Ϊ���ͣ�Fe+Cu2+�TFe2++Cu��
��2�����ܸ�Ϊ����ʱ�����ձ��������ŨCuSO4��Һ������Fe��Cuԭ��أ�FeΪ����������Fe-2e-�TFe2+��CuΪ����������Cu2++2e-�TCu����A�˸ߣ�B�˵ͣ�
�ʴ�Ϊ���ߣ�Cu2++2e-�TCu��Fe-2e-�TFe2+��
��3�����ܸ�Ϊ����ʱ��FeΪ����������Fe-2e-�TFe2+��CuΪ����������Cu2++2e-�TCu����ͨ���ܸ˵�����Ϊ0.1NA�����ܽ����Ϊ0.05mol��0.05��56=2.8g��������ͭΪ0.05mol��0.05��64=3.2g�����������������2.8+3.2=6 g���ʴ�Ϊ��6��
���� ���⿼��ԭ��ؼ���ѧ��Ӧ����ȷ�ܸ��Ƿ缰�����ķ�Ӧ�ǽ����Ĺؼ���ѧ�������Ըܸ�Ϊ��Ե��ʱ���������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 80% | B�� | 75% | C�� | 60% | D�� | 40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���ݻ�һ�����ܱ������У����淴Ӧ��A2 ��g��+B2��g��?xC��g�� ��������ͼ����ʾ��ϵ���ɴ��ƶϣ���ͼ���˵����ȷ���ǣ�������
���ݻ�һ�����ܱ������У����淴Ӧ��A2 ��g��+B2��g��?xC��g�� ��������ͼ����ʾ��ϵ���ɴ��ƶϣ���ͼ���˵����ȷ���ǣ�������| A�� | P3��P4��Y���ʾ��������ƽ��Ħ������ | |
| B�� | P3��P4��Y���ʾ���������ܶ� | |
| C�� | P3��P4��Y���ʾA2��Ũ�� | |
| D�� | P3��P4��Y���ʾA2��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=0����Һ�У�ClO-��Cu2+��SO42-��K+ | |
| B�� | ʹpH��ֽ���ɫ����Һ�У�Fe2+��I-��NO3-��Cl- | |
| C�� | �ܹ��ͽ���þ��Ӧ�ų��������Һ�У�Na+��H+��SO42-��Cl- | |
| D�� | �����£�ˮ�������c��H+����c��OH-���˻�Ϊ10-28����Һ�У�K+��Na+��HS-��Ca2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | A | B | C | D | E | F | G | H | I | J |
| ԭ�Ӱ뾶��10-10m�� | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| ������� | +6 | +1 | �� | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| ����� | -2 | �� | -2 | �� | -4 | -3 | -1 | �� | -3 | -4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ�ȡ����� | B�� | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C�� | N2��CO | D�� | 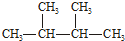 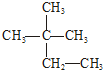 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com