
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是( )
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
C.通入HCl, A-的水解程度增大,HA的电离常数减小
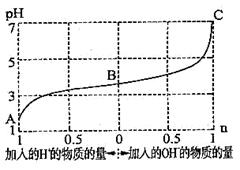 D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
科目:高中化学 来源: 题型:
不同的金属,其冶炼方法可能不同,主要原因是( )
A.金属的活动性不同
B.金属在自然界中的分布不同
C.金属在自然界中的存在形式不同
D.金属在自然界中的含量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案并将实验结果记录如下,能证明铁的金属性比铜强的是( )
| 方 案 | 现象或产物 | |
| A | 将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| B | 将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| C | 将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| D | 将铁片和铜片分别置于热的稀硝酸溶液中 | 铁片上、铜片上均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)  Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是( )
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是( )
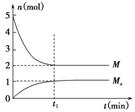
A.该反应的化学方程式是2HF (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时,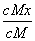 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
化学已渗透到人类生活的方方面面,下列说法正确的是( )
A.离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜
B.白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g酒精
C.开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径
D.泡沫灭火器是最常见的灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1) 仪器A的名称是__________,
水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________( ①=10 mL,②=40 mL,③<10 mL,④>40 mL )
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
________________________________________________________________________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是( )
c(Na+) = c(HSO )+ 2c(SO
)+ 2c(SO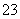 )
)
c(Na+) > c(HSO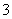 ) = c(SO
) = c(SO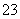 ) > c(H+) = c(OH-)
) > c(H+) = c(OH-)
2c(Na+) = 3c(H2SO3)+3c(HSO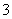 )+3c(SO
)+3c(SO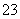 )
)
c(Na+) > c(HSO3- ) + c(SO32- ) +c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物A分子中含有3个碳原子,有关它的某些信息注明在下面的示意图中。

试回答下列问题:
(1)A、F、G的结构简式分别为_____________、_____________、_____________。
(2)D生成E的化学方程式为____________________________________________。
(3)生成H的化学方程式为_____________________________________________。
(4)C在一定条件下可以生成一种高聚物,写出该反应的方程式_____________
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分元素的性质与原子(或分子)结构如表所示:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
(1)写出元素T的原子结构示意图________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填字母)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com