
| m |
| V |
| 0.18mol×1 |
| 2 |
| ||
| 0.5min |


科目:高中化学 来源: 题型:
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 180 | 68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 160 | 57 | 2500 |
| A、SiCl4是分子晶体 |
| B、单质B可能是原子晶体 |
| C、AlCl3加热能升华 |
| D、NaCl的键的强度比MgCl2小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
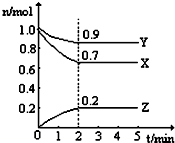 某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示:
某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com