
【题目】下述实验方案能达到实验目的的是( )
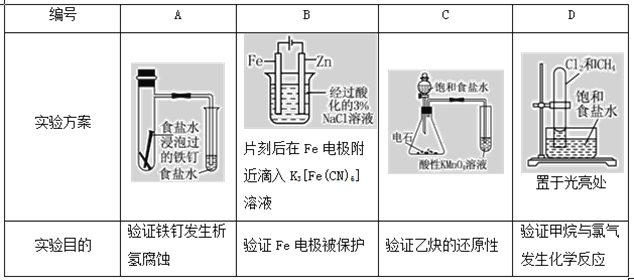
A.A
B.B
C.C
D.D
【答案】D
【解析】
A. 食盐水为中性,发生吸氧腐蚀;
B. Fe与电源正极相连;
C. 电石和水反应生成的乙炔中含有还原性的H2S等杂质,H2S等还原性气体能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色;
D. 光照下甲烷与氯气发生取代反应,生成HCl极易溶于水。
A. 食盐水为中性,发生吸氧腐蚀,该实验方案能达到实验目的,A项错误;
B. Fe与电源正极相连,作阳极,发生氧化反应,Fe电极被腐蚀,B项错误;
C. 电石和水反应生成的乙炔中含有还原性的H2S等杂质,H2S等还原性气体能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,会干扰乙烷的检验,所以无法实现实验目的,C项错误;
D. 光照下甲烷与氯气发生取代反应,生成HCl极易溶于水,装置可验证甲烷与氯气发生化学反应,D项正确;
答案选D。
类型 | 析氢腐蚀 | 吸氧腐蚀 | |
条件 | 水膜酸性较强(pH≤4.3) | 水膜酸性很弱或呈中性 | |
电极反应 | 负极 | Fe-2e-===Fe2+ | |
正极 | 2H++2e-===H2↑ | O2+2H2O+4e-===4OH- | |
总反应式 | Fe+2H+===Fe2++H2↑ | 2Fe+O2+2H2O===2Fe(OH)2 | |
联系 | 吸氧腐蚀更普遍 | ||


科目:高中化学 来源: 题型:
【题目】(1)有机化合物的结构简式可进一步简化,如:![]()
根据题目要求回答下列问题:
①有机物 ![]() 与氢气发生化学反应的化学方程式为(用结构简式书写):______。
与氢气发生化学反应的化学方程式为(用结构简式书写):______。
②β-月桂烯的结构简式为![]() ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有____种。
,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有____种。
(2)下列几种烃类物质:


① 正四面体烷的二氯取代产物有__________种;立方烷的二氯取代产物有__________种。
② 关于苯和环辛四烯的说法正确的是___________(填字母符号)。
A .都能使酸性KMnO4溶液褪色
B .都能与H2发生加成反应,等质量的苯和环辛四烯消耗H2的物质的量之比为3:4
C .都是碳碳单键和碳碳双键交替结构
D .都能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
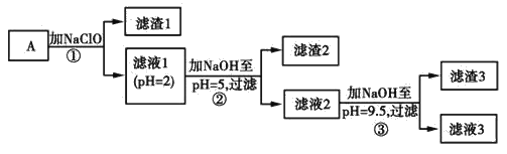
【题目】某矿样用过量酸溶解并过滤,所得滤液A主要含CO32-、Ni2+、SO42-、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
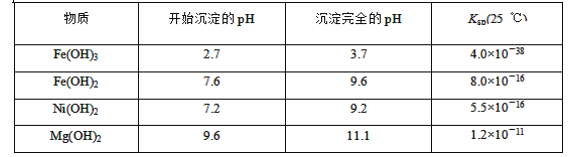
可能用到的有关数据如下:
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5mol·L-1,应保持溶液中c(C2O42-)≥_____mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为_____。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将____(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量_____(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
乙醛溶液进行下列实验.
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
(1)上表中a、b应为(填字母序号)。___________________
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是___________。
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀。该反应的化学方程式为_________。
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是_______________。
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是__________________基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com