
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
| 1 |
| 2 |
 ,
, ;
;| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、氨气溶于水所得溶液虽然能导电,但该溶液中不含电解质 |
| B、利用盐类的水解,可用FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
| C、在实验室可通过配制相同PH值的盐酸和醋酸,通过多种实验方案对比证明CH3COOH是弱电解质 |
| D、用漂白粉制次氯酸的反应可以说明HClO和CO32-可以共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Al2(SO4)3溶液中通入NH3 |
| B、向NaHCO3溶液中滴入烧碱溶液 |
| C、向淀粉-KI溶液中通入NO2气体 |
| D、向含酚酞的NaOH溶液中通入SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇、乙醇 |
| B、甲醇、丙醇 |
| C、丙醇、丁醇 |
| D、丁醇、戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
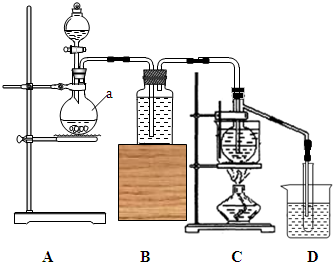 实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))
实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、④⑤⑥⑧ |
| C、除④⑧外 | D、⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com