
| A. | 非金属氧化物一定都是酸性氧化物 | |
| B. | 碱性氧化物一定都是金属氧化物 | |
| C. | 既能与酸反应又能与碱反应的物质一定具有两性 | |
| D. | 氧化还原反应一定都是离子反应 |
分析 A.酸性氧化物不一定是非金属氧化物,可能是金属氧化物;
B.能和酸反应只生成盐和水的氧化物是碱性氧化物;
C.碳酸氢铵、碳酸铵等均与酸、碱反应;
D.有离子参加或生成的反应属于离子反应,存在化合价变化的反应是氧化还原反应.
解答 解:A.酸性氧化物不一定是非金属氧化物,如Mn2O7,是酸性氧化物,但是金属氧化物,故A错误;
B.能和酸反应只生成盐和水的氧化物是碱性氧化物,碱性氧化物肯定是金属氧化物,金属氧化物不一定是碱性氧化物,故B正确;
C.碳酸氢铵、碳酸铵等均与酸、碱反应,碳酸铵显碱性,既能与酸又能与碱反应的物质不一定是两性物质,故C错误;
D.有离子参加或生成的反应属于离子反应,存在化合价变化的反应是氧化还原反应,氧化还原反应不一定都是离子反应,如氢气与氧化铜的反应是氧化还原反应,不是离子反应,故D错误.
故选B.
点评 本题考查氧化还原反应、物质的分类,为高频考点,侧重于基本概念的理解,要求学生能熟练把握物质的性质,答题时能举出实例,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 根据表中数据不能计算出混合物中NaHCO3的质量 | |
| B. | 根据表中数据可救出盐酸的物质的量浓度为3mol•L-1 | |
| C. | 加入混合物9.2 g时恰好与盐酸完全反应 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
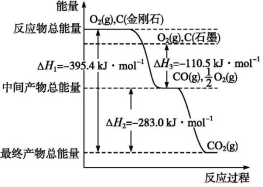 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为Fe3+具有氧化性,所以可以用KSCN溶液检验Fe3+ | |
| B. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | FeCl2溶液蒸干灼烧后得到FeCl2固体 | |
| D. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
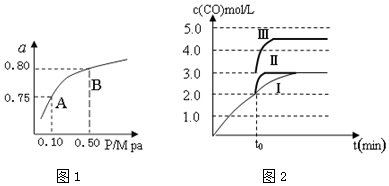
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com