
| A、NaCl HCl H2SO4 AgNO3 |
| B、CuSO4 NaOH BaCl2 HCl |
| C、KCl HCl NaOH BaCl2 |
| D、NaOH KOH MgCl2 H2SO4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、0.3 mol NO2 |
| B、0.3 mol NO、0.1 mol NO2 |
| C、0.6 mol NO |
| D、0.3 mol NO2、0.1 mol NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
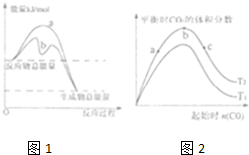 工业上研究燃料脱硫的过程中,涉及如下反应:
工业上研究燃料脱硫的过程中,涉及如下反应:| 1 |
| 2 |
| 1 |
| 2 |
| t/s | 0 | 50 | 100 | 150 | 200 |
| C(CO)/mol.L- | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸,氢氧化钠,碳酸钠,硫酸钠 |
| B、盐酸,氢氧化钠,酚酞,硫酸铜 |
| C、氢氧化钠,硫酸镁,碳酸钠,硫酸钠 |
| D、氯化钡,硫酸钠,氯化钙,硝酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL |
| B、200 mL |
| C、450 mL |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
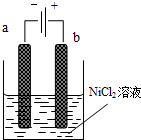 三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:
三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)?2C(气)△H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)?2C(气)△H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )| X | Y | |
| A | 减小压强 | A的转化率 |
| B | 升高温度 | 混合气体平均分子量 |
| C | 升高温度 | A的浓度 |
| D | 增加压强 | B的转化率 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com