
【题目】采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是

A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn![]() ZnC2O4
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
【答案】C
【解析】
采用电化学法还原CO2制备ZnC2O4的过程中,碳元素的化合价降低,所以通入二氧化碳的电极是阴极,即Pb是阴极,和电源的负极相连,Zn是阳极,和电源的正极相连,总反应为:2CO2+Zn![]() ZnC2O4,根据反应式计算。
ZnC2O4,根据反应式计算。
A、采用电化学法还原CO2制备ZnC2O4的过程中,碳元素的化合价降低,所以通入二氧化碳的电极是阴极,即Pb是阴极,和电源的负极相连,Zn是阳极,和电源的正极相连,选项A错误;
B、在阴极上,二氧化碳得电子得C2O42-,在阳极上,金属锌失电子成为锌离子,从阳极移向阴极,所以ZnC2O4在交换膜左侧生成,选项B错误;
C、在阴极上,二氧化碳得电子得C2O42-,在阳极上,金属锌失电子成为锌离子,电解的总反应为:2CO2+Zn![]() ZnC2O4,选项C正确;
ZnC2O4,选项C正确;
D、电解的总反应为:2CO2+Zn![]() ZnC2O4,2mol二氧化碳反应伴随2mol电子转移,当通入标况下的11.2 L CO2时,转移0.5 mol电子,但题干中没说明标准状况下,选项D错误.
ZnC2O4,2mol二氧化碳反应伴随2mol电子转移,当通入标况下的11.2 L CO2时,转移0.5 mol电子,但题干中没说明标准状况下,选项D错误.
答案选C。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)在这些元素中,最活泼的金属元素与最活泼的非金属元素形成的化合物是:_____(填化学式)。
(2)元素③、④、⑤的最高价氧化物的水化物中碱性最强的物质的电子式是:_______________;元素⑥、⑦、⑧的最高价氧化物的水化物的酸性最弱是_____________(填化学式)。③⑤⑧三种物质最高价的氧化物对应水化物两两能相互发生反应,写出⑤的最高价氧化物的水化物分别与③、⑧的最高价氧化物对应水化物反应的离子方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是乙酸乙酯的制备、分离、提纯、性质验证的实验装置,下列有关说法正确的是

选项 | 功能 | 装置 | 实验的操作或评价 |
A | 制备 | a | 试管中NaHCO3溶液的作用:反应掉挥发的乙酸,溶解乙醇,有利于乙酸乙酯的收集 |
B | 蒸馏 | b | 应把温度计插入液面以下,以便准确测出各馏分的温度 |
C | 分液 | c | 打开分液漏斗的旋塞,让乙酸乙酯缓缓流入烧杯中 |
D | 水解 | d | 碱性条件下水解完全的标志为溶液不再分层 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙可用生产疏酸、漂白粉等一系列物质。下列说法正确的是
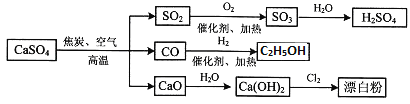
A.由CO与H2合成CH3CH2OH的反应中,原子利用率为100%
B.向蔗糖中加入浓硫酸,蔗糖变黑并产生刺激性气味的气体,说明浓硫酸具有脱水性和强氧化性
C.二氧化硫和漂白粉都能使品红溶液褪色,两者漂白性质相同
D.图中所有反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室用浓硫酸和乙醇在170℃的条件下制备乙烯(140℃时生成乙醚)。某学习小组设计实验证明浓硫酸在该反应中的还原产物有SO2,并制备1,2-二溴乙烷(装置可以重复使用)。
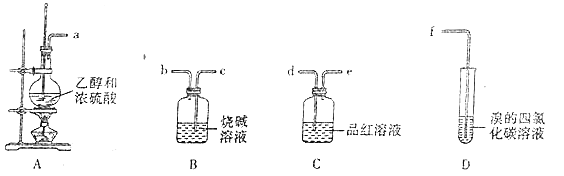
下列说法错误的是( )
A. 加热时迅速将温度升高至170℃,减少生成副产品
B. 导管接口连接顺序为a→d→e→c→b→d→e→f
C. 装置B中的试剂可以换成酸性高锰酸钾溶液
D. 实验完毕后,采用蒸馏操作分离提纯1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2回收与利用是环境科学家研究的热点课题。利用CO2制备合成气(CO、H2),再制备高值产品,如甲醇等,也可以利用CO2直接制备甲醇等产品。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | 2CO(g)+O2(g)===2CO2(g) | 1954 | 2519 |
② | H2(g)+ | 685 | 970 |
③ | 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) | 3526 | 4978 |
在相同条件下,起始反应最快的是____(填序号)。由H2和CO合成气态甲醇的热化学方程式为________。
(2)T1℃下,在2L恒容密闭容器中充入0.20mol CO和0.60mol H2合成CH3OH,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
①T1℃时,以H2表示的反应的平均速率为___,平衡常数K=____。
②(T1+100)℃时,在1L恒容密闭容器中充入0.10molCO、0.20molH2和0.30mol CH3OH,此时反应将____(填“向左移动”“向右移动”“达到平衡”或“无法判断”)。
(3)CO2和H2在催化剂作用下反应,可以直接合成甲醇:CO(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
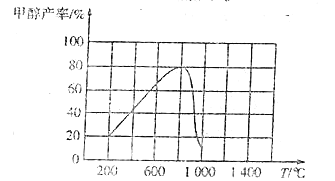
①温度在800℃时甲醇产率最高的主要原因是/span>____。
②下列措施能提高CO2平衡转化率的是____(填字母)。
A.升温 B.加压 C.加入催化剂 D.增大H2浓度
(4)利用电解法在酸性条件下将CO2和H2O转化或CO和H2,阴极反应式之一为CO2+2e-+2H+=CO+H2O,其机理如下:①CO2+2e-+H2O===CO+2OH-(慢反应);②OH-+CO2=HCO3-(快反应);③HCO3-+H+=CO2+H2O(快反应)。其中水的作用是___;控制阴板反应速率的反应是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:
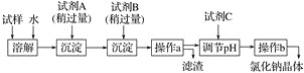
请回答以下问题:
(1)在所提供的试剂中选择:试剂B是____。
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。

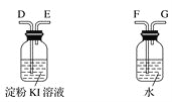
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接___,___接____;B接____,____接____。
(4)电解氯化钠溶液时的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。

方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com