
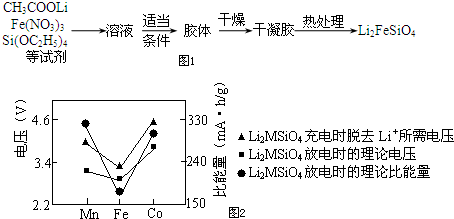
分析 (1)依据亚铁离子具有还原性分析;根据反应2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2可知,反应中各元素化合价没有变化,也无法判断反应的执效应,但Li2SiO3 和Li2FeSiO4都属于硅酸盐,据此答题;
(2)依据胶体的特征性质分析设计实验验证,依据溶胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,根据化合价的变化分析;
(3)放电时原电池反应,正极上是得到电子发生还原反应,电池反应中元素化合价降低得到电子,依据总反应式分析判断;
(4)依据图象变化意义分析;
解答 解:(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,根据反应2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2可知,反应中各元素化合价没有变化,也无法判断反应的执效应,但Li2SiO3 和Li2FeSiO4都属于硅酸盐,故③正确,
故答案为:防止二价铁被氧化;③;
(2)胶体具有丁达尔现象,取少量液体,用一束强光光线照射,有丁达尔现象证明是胶体;胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,若制得1mol Li2FeSiO4,电子转移1mol,
故答案为:取少量液体,用一束强光光线照射,有丁达尔现象;1mol;
(3)总反应式可表示为Li2FeSiO4$?_{放电}^{充电}$Li+LiFeSiO4,放电过程中是原电池反应,Li做负极失电子发生氧化反应,LiFeSiO4在正极上得到电子发生还原反应,电极反应为LiFeSiO4+Li++e-=Li2FeSiO4,
故答案为:Li;LiFeSiO4+Li++e-=Li2FeSiO4 ;
(4)实际应用时,常用铁元素来源丰富的Li2FeSiO4作电极材料,分析图象变化可知,使用该电极材料的另一个优点是Li2FeSiO4 充电时脱去Li+所需电压低,
故答案为:Li2FeSiO4 充电时脱去Li+所需电压低.
点评 本题考查了物质制备实验分析判断、氧化还原反应、原电池原理的应用等,注意氧化还原反应分析和电子转移计算应用,原电池反应和电极反应书写,图象分析判断是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:选择题
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3-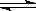 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g /mol D.32g /mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
已知反应①2BrO3﹣+Cl2=Br2+2ClO3﹣;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3﹣+5Cl﹣+6H+=3Cl2+3H2O,下列有关氧化(还原)能力强弱顺序正确的是( )
A.还原性:C l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
C.氧化性:BrO3﹣>ClO3﹣>Cl2>IO3﹣ D.氧化性:Cl2>BrO3﹣>C1O3﹣>IO3﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
如图是某市售盐酸试剂瓶标签上的部分数据.则该盐酸的物质的量浓度是( )
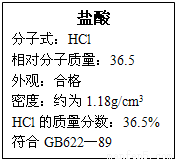
A.3 mol/L B.8.4 mol/L C.11.8 mol/L D.0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 大于0.2mol小于0.4mol | ||
| C. | 0.2mol | D. | 小于0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指某一时刻,某种反应物的瞬时反应速率 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指反应1 s时某物质的浓度为0.8mol•L-1 | |
| C. | 对于一个化学反应来说,其反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以推知化学反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com