
 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.分析 (1)反应物为亚氯酸钠,所在环境为酸性环境,生成物为ClO2气体,且知此反应为歧化反应,据此书写离子反应方程式即可;改加pH相同的硫酸,氢离子浓度不变,应考虑氯离子的影响;
(2)①与电源负极相连的一极为阳极,溶液中的阳离子在此电极得到电子,发生还原反应;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2;
(3)2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 (i),2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1(ii),[(i)-(ii)]÷2得目标方程式,利用三段法计算平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,据此解答即可.
解答 解:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,
故答案为:5ClO2-+4H+=4ClO2↑+Cl-;反应生成的氯离子对该反应起催化作用;
(2)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O;
(3)2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 (i),2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1(ii),[(i)-(ii)]÷2得:NO2(g)+SO2 (g)?SO3 (g)+NO(g),故△H=$\frac{-196.6-(-113.0)}{2}$=-41.8(KJ/mol),
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{C(S{O}_{3})C(NO)}{C(N{O}_{2})C(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{16}{25}{a}^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案为:-41.8;$\frac{8}{3}$.
点评 本题以ClO2、NO2、SO2、CO等物质为载体,综合考查离子方程式、化学平衡移动、盖斯定律以及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 可通过电解熔融MgCl2来制取金属镁,故也能通过电解熔融AlCl3来制取铝 | |
| C. | 铝热剂、盐酸、水玻璃、双氧水、明矾均为混合物 | |
| D. | Na2O2、NaOH、NH4Cl均为含共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
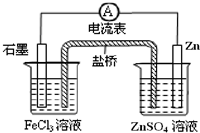 根据下列原电池示意图,回答下列问题:
根据下列原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D的最简式CH2;
;D的最简式CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.
+HBr,其反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
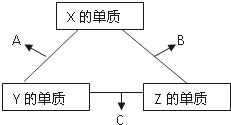 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式可表示为CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 甲烷的结构式:CH4 | D. | 甲苯的键线式可表示为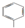 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
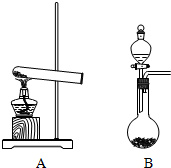 如图,实验室制取氨气有几种方法,
如图,实验室制取氨气有几种方法,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第I A族元素都是碱金属元素 | |
| B. | 元素周期表中有18个纵行,所以有18个族 | |
| C. | 可以从过渡金属中寻找新型催化剂 | |
| D. | 主族元素的金属元素原子最外层电子数一定小于或等于4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Joseph John Thomson | B. | Ernest Rutherford | ||
| C. | Justus von Liebig | D. | Jons Jakob Berzelius |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com