
A.温度不变,缩小体积,ClF的转化率增大
B.温度不变,增大体积,ClF3的产率增高
C.升高温度,增大体积,有利于平衡向正反应方向移动
D.降低温度,体积不变,F2的转化率降低
解析:本题所列反应是正反应为放热、体积缩小的可逆反应。可依据温度、压强、浓度的变化对平衡的影响以及气体的体积和压强、浓度的关系进行判断。
A项温度不变,缩小气体的体积,根据玻意耳气体定律(PV=C)可知气体的压强必然增大,使平衡向正反应方向移动,所以,ClF的转化率增大。即A选项的说法正确。
B项温度不变,增大体积,其压强必然减小,使平衡向逆反应方向移动。所以,ClF3的产率应降低,不应增高。故B选项的说法不对。
C项升高温度,对放热反应来说,可使平衡向逆反应方向移动。同时,增大体积即减小压强,亦使平衡向逆反应方向移动。故C选项错。
D项降低温度,体积不变,有利于平衡向放热反应方向移动,使F2的转化率升高。故D选项错。
答案:A


科目:高中化学 来源: 题型:
 9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2 (4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是
(4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
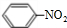
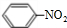
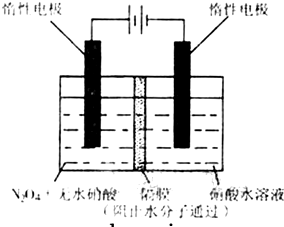
| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?湖南二模)(1)已知可逆反应:M(g)+N(g)
(2011?湖南二模)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
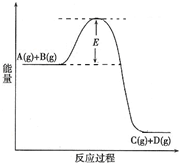 (2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.
(2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com