
【题目】指出下列反应中的氧化剂和还原剂,写出发生氧化反应和还原反应的物质中对应元素的名称:
(1)2KMnO4![]() K2MnO4+MnO2+O2↑,___________
K2MnO4+MnO2+O2↑,___________
(2)2KNO3+3C+S![]() K2S+3CO2↑+N2↑,_________
K2S+3CO2↑+N2↑,_________
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液
(1)这4种溶液中由水电离的H+浓度最小的是__________。(填序号)
(2)②中各离子浓度由大到小的顺序是_____________,NaHCO3的水解平衡常数Kh=__________mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时![]() 的值__________(填“增大”、“减小”或“不变”)。
的值__________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。

请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有________ (填字母)。
a. 天平 b. 烧杯 c. 漏斗 d. 玻璃棒
(2)OA段反应的离子方程式为_____________________________________。
(3)AB段反应的离子方程式为________________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是______________________,反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾 (K2CrO4) 为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。制备装置如下图所示(阳离子交换膜只允许阳离子透过)下列说法错误的是

A. 阳极室中溶液的颜色逐渐由黄色变为橙色
B. 电解的过程中阳极附近溶液pH变大
C. 阴极每生成lmo1气体,电路中转移2NA个电子
D. 过程总反应的离子方程式可为4CrO42-+4H2O=2Cr2O72-+4OH-+2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:
(1)在30mL的大试管 ①中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
(2)按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;

(3)待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层;
(4)分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液时,浓硫酸、乙醇、乙酸的滴加顺序是:_______。写出制取乙酸乙酯的化学方程式 ________。
(2)试管②中所加入的物质是:________,作用为_________。
A.中和乙酸和乙醇;
B.中和乙酸并吸收部分乙醇;
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出;
D.加速酯的生成,提高其产率。
(3)步骤(2)中需要小火均匀加热,温度不能太高,其主要理由是:_____(答一条即可)。
(4)分离出乙酸乙酯层所用到的主要仪器是________;为了干燥乙酸乙酯可选用的干燥剂为(填字母):_______。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芯片是中美经贸摩擦的焦点之一。制造芯片的高纯硅可以用下述方法制取(反应条件略),下列说法错误的是:

A. 反应①、③均为置换反应
B. SiCl4中Si的化合价为+4
C. Si是金属元素,因此制造芯片的高纯硅具有导电性
D. 硅原子的核电荷数为14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________(填仪器名称);需要量取98%浓硫酸____________mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(___________)。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____(填序号);

(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________mL 4.6mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的叙述中,下列叙述不正确的是
A.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.王水是浓盐酸和浓硝酸按 3:1 混合,具有很强的腐蚀性,可以腐蚀金和铂
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B原子的最外层只有一个电子,C的原子结构示意图如图,D在同周期元素中原子半径最小,据此填空:
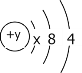
(1)C元素的名称为____,其气态氢化物的化学式为___。
(2)D在周期表的___周期,___族。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为(用化学式填写)___
(4)B的最高价氧化物的水化物的化学式为__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com