
【题目】某化学实验兴趣小组的同学从海带中提取碘单质的实验流程图如下:

依据实验下列说法不正确的是( )
A. 从上述实验可以得出海带中含有可溶性的含碘化合物
B. 步骤⑤中可能发生的反应为:5I- + IO3- +6H+ ===3I2 +3H2O
C. 若步骤④中用CCl4做萃取剂,步骤⑥应取上层溶液得到后续的混合物C
D. 整个过程中的操作是利用了物质的溶解性实现了碘元素的富集、分离与提纯
【答案】B
【解析】
由流程可知,海带溶解后倾倒分离出残渣,混合物A酸化氧化后萃取分液得到混合物B,混合物B中含碘单质,步骤⑤中加NaOH后分离出的混合物C中含I-、IO3-,最后加硫酸发生5I-+IO3-+6H+═3I2+3H2O,又析出碘,达到碘元素的提取,据此分析解答。
A.由上述分析可知,海带中含有可溶性的含碘化合物,故A正确;
B.步骤⑤中碘与氢氧化钠溶液发生的反应可能为3I2+6OH-=5I-+IO3-+3H2O,故B错误;
C.若步骤④中用CCl4做萃取剂,有机层在下层,步骤⑤中碘与NaOH反应生成的含碘化合物易溶于水,进入水层,则步骤⑥应取上层溶液得到后续的混合物C,故C正确;
D.根据流程,结合上述分析,实验过程中是利用了物质的溶解性实现了碘元素的富集、分离与提纯,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填序号),一定不变的是________(填序号)。一定变大的是________(填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锂电池应用广泛, 电池放电后负极材料主要含有Li4Ti5O12、 铝箔及少量Fe, 可通过下列工艺流程回收钛、 锂。回答下列问题:

(1) Li4Ti5O12中, Ti元素的化合价为___, 滤液1中含金属的阴离子是___(填离子符号)。
(2) 酸浸时 Li4Ti5O12发生的反应是: Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O, 该反应是否属于氧化还原反应?___(填 “是” 或 “否”); 滤渣1是___。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液发生反应的离子方程式为___。
(4) 向TiOSO4溶液中通入NH3发生反应的离子方程式为___。
(5) 沉淀TiO(OH)2用蒸馏水洗涤的目的是___。
(6) 萃取时, 温度对萃取率的影响如图所示。由图分析知实验时选择在常温下进行即可, 理由是__。

(7)“萃取” 和 “反萃取” 可简单表示为:[TiO(H2O2)]2++2(HA)2![]() [TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
[TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因 ( 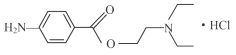 ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:

回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-四氢呋喃甲醇是合成农药呋虫胺的中间体,其合成路线如下:

已知:① RCl ![]() NCN
NCN ![]() RCOOH
RCOOH
② R1COOR2 + R318OH ![]() R1CO18OR3 + R2OH
R1CO18OR3 + R2OH
③ R1COOR2 ![]() R1CH2OH + R2OH
R1CH2OH + R2OH
请回答下列问题:
(1)A生成B的反应类型是__________,B中含有的官能团是___________。
(2)D发生酯化反应生成E的化学方程式为___________。
(3)3-四氢呋喃甲醇有多种同分异构体,请写出其中两种符合下列条件的有机物的结构简式:______________________。
①能发生水解反应 ②分子中有3个甲基
(4)G的结构简式为__________。
(5)生成G的过程中常伴有副反应发生,请写出一定条件下生成高分子聚合物的化学方程式:________。
(6)还可以利用![]() 与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
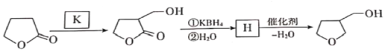
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是

A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是_________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+离子中的大π键应表示为________。
),则EMIM+离子中的大π键应表示为________。

(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com