

| A. | 还原性 | B. | 与水反应的剧烈程度 | ||
| C. | 熔点 | D. | 原子半径 |
分析 碱金属元素中,随着碱金属的核电荷数的增大,元素的金属性逐渐增强,原子半径逐渐增大,金属晶体的熔点逐渐降低.
解答 解:A.碱金属元素中,随着碱金属的核电荷数的增大,元素的金属性逐渐增强,单质的还原性逐渐增强,故A正确;
B.碱金属元素中,随着碱金属的核电荷数的增大,元素的金属性逐渐增强,与水反应的剧烈程度逐渐增大,故B正确;
C.碱金属元素中,随着碱金属的核电荷数的增大,金属晶体的金属键作用力减弱,熔点逐渐降低,故C错误;
D.碱金属元素中,随着碱金属的核电荷数的增大,核外电子层数逐渐增多,电子层数越多,半径越大,故D正确.
故选ABD.
点评 本题考查同主族元素性质的递变规律,题目难度不大,注意元素周期律知识的积累.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | a-4 | B. | a+3 | C. | a+3 | D. | a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
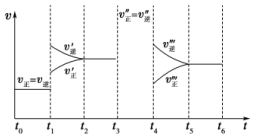 密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.
密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
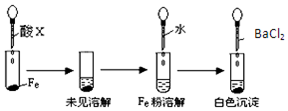 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
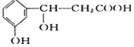 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
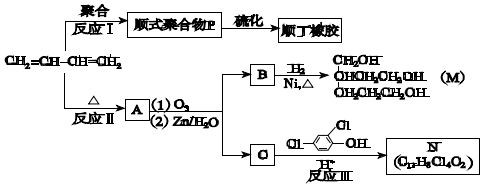
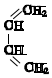 +
+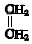 $\stackrel{△}{→}$
$\stackrel{△}{→}$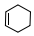
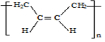 ;
;
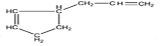
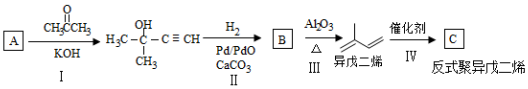
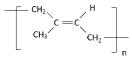 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
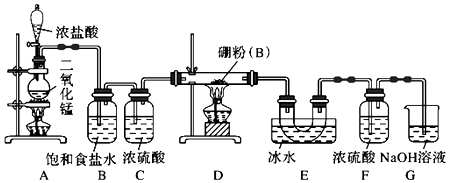
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com