
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中; |
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

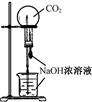
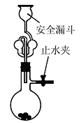
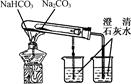
| A.测定一定时间内生,成H2的反应速率 | B.用CO2做,喷泉实验 | C.实验室制氢气 | D.比较Na2CO3与,NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
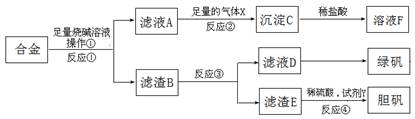
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.配制银氨溶液:在一定量AgNO3溶液,滴加氨水至沉淀恰好溶解。 |
| B.在检验醛基配制Cu(OH)2悬浊液时:在一定量CuSO4溶液中加入少量NaOH溶液 |
| C.验证RX为碘代烷,把RX与烧碱水溶液混合加热将溶液冷却后再加入硝酸银溶液 |
| D.无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
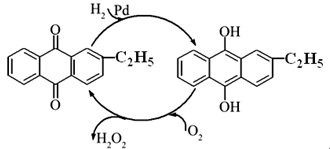
| 实验编号 | T/℃ | H2O2初始浓度/ mol·L-1 | FeCl3初始浓度/ mol·L-1 |
| Ⅰ | 20 | 1.0 | |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | | 0.1 |
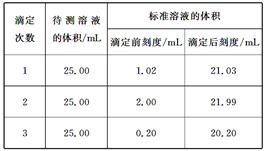
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性H2O2比Fe3+强 |
| B | 在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 验证盐类水解反应是吸热反应 |
| C | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 | 除去铁屑表面的油污 |
| D | 苯酚钠溶液中通入足量二氧化碳产生浑浊 | 苯酚的酸性弱于碳酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com